|
|
|
|
L'invention
du ciment est attribuée à Louis Vicat qui en 1818 fabrique de manière
contrôlée des chaux hydrauliques dont il définit les composants et
leurs proportions.
Structure.
Le calcium a pour numéro atomique Z = 20.
Quelle est sa configuration électronique àl'état fondamental ? Sous quelle forme ionique le rencontre-t-on habituellement ?
1s2 2s2 2p6 3s2 3p6 4s2.
L'atome perd facilement deux électrons ( règle de l'octet ) et donne l'ion Ca2+ possédant une couche électronique externe saturée à 8 électrons.
Le calcium appartient à la famille des alcalino-terreux.
Donner les numéros atomiques des trois éléments voisins de la même colonne. ( sur les lignes précédentes et la ligne suivante de la classification périodique ).
Be ( Z = 4) ; Mg ( Z = 12 ) ; Strontium ( Z = 38).
Cristallographie.
Le calcium existe sous deux variétés cristallines : Caa correspond à un arrangement cubique faces centrées et Caß à un systèmecubique centré.
Représenter une maille conventionnelle du calcium a. Calculer le rayon de l'atome de calcium, la masse volumique du cristal et la coordinence des atomes dans cette maille. a = 559 pm.
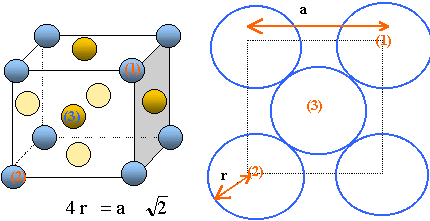
Il y a contact des sphères suivant la diagonale
d'une face du cube.
r= 559*1,414 / 4 ~ 198
pm.
Chaque maille compte en propre :
- chaque atome situé au centre d'une face,
donc commun à deux mailles compte pour ½ : il y
a 6 faces soit 6*0,5 = 3 atomes.
- chaque atome situé à un sommet, donc
commun à huit mailles compte pour 1/8 : il y a huit
sommets donc 1 atome. Total : 4 atomes de calcium par maile.
Masse d'une maille : m = 4M(Ca) / NA = 4*40,1 10-3 / (6,02 1023) =2,66 10-25 kg.
Volume d'une maille : V = a3 = (559 10-12)3 =1,75 10-28 m3.
Masse volumique m / V = 2,66 10-25 / 1,75 10-28 = 1,53 103 kg m-3.
La coordinence est le nombre de plus proches
voisins d'une sphère quelconque, ces voisins étant tangents à la sphère
envisagée. Dans cette maille la coordinence des atomes est égale à 4.
On suppose que le calcium garde le même rayon dans la forme ß.
Quel serait le paramètre de la maille cubique centrée ? 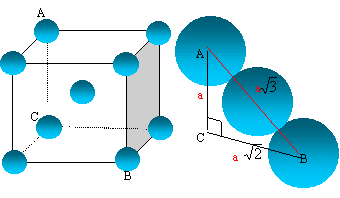
La tangence s'effectue suivant la grande diagonale du
cube : a racine
carrée (3) = 4 R
a = 4*198 / 1,732 = 457 pm.
En fait la valeur est a = 448 pm. Le calcium ne garde pas le même rayon.
|
.
|
L'industrie cimentière.
L'élaboration des ciments se fait dans un four à partir d'un mélange de 80 % de calcaire CaCO3 et de 20 % d'argile ( assimilé à un mélange d'alumine Al2O3 et de silice SiO2 ). Le composé obtenu majoritairement est Ca3SiO5 ( le Ca3S des cimentiers ).
Ecrire l'équation de la réaction conduisant à la formation de Ca3SiO5 solide et de CO2(g) à partir de la silice et du calcaire.
3CaCO3 (s)+ SiO2 (s) = Ca3SiO5(s) + 3CO2(g). (1).
Calculer l'enthalpie standard de réaction à 298 K.
DrH° = 3DfH° (CO2(g)) + DfH° ( Ca3SiO5(s)) -3DfH° (CaCO3 (s)) - DfH° (SiO2 (s)).
DrH° =3(-393,1) +(-2876) -3*(-1206) -(-910,0) = 472,7 kJ mol-1.
Quelle est l'influence de la température sur l'équilibre de cette réaction ?
DrH° est positif, la réaction est endothermique : une élévation de température déplace l'équilibre dans le sens direct.
Quelle quantté de chaleur faut-il fournir ( à P et T =298 K constantes ) à une tonne de calcaire pour le transformer par la réaction (1) en Ca3SiO5 et quelle est la masse de CO2 produite ? M(CaCO3) = 40,1 + 12 +3*16 =100,1 g/mol.
n = m / M = 1,0 106 / 100,1 = 9,99 103 mol de calcaire, donc 9,99 103 /3 =3,33 103 mol de Ca3SiO5 et 9,99 103 mol de CO2.
Q = 3,33 103 *472,7= 1,57 106 kJ.
Masse de dioxyde de carbone : M(CO2) * 9,99 103 = 44 * 9,99 103 =4,4 105 g ou 0,44 tonne.
Ce four fonctionne avec du méthane CH4(g) et du dioxygène O2(g).
La combustion d'une mole de méthane fournit 690 kJ à la pression P0 et à la température de 298 K.
Quelle masse de méthane faut-il brûler ?
Quantité de matière de méthane : 1,57 106 / 690 =2,275 103 mol.
Masse de méthane =M(CH4) * 2,275 103 = 16*2,275 103 =3,64 104 g ~36 kg.
Quelle masse de dioxyde de carbone est produite par le four ? Conclure.
CH4(g) + 2 O2(g) = CO2(g) + 2H2O(g).
Quantité de matière totale de dioxyde de carbone : 2,275 103 + 9,99 103 =1,2265 104 mol.
Masse de dioxyde de carbone : 44*1,2265 104 =5,4 105 g = 0,54 t par tonne de calcaire.
L'industrie cimentière contribue largement à l'effet de serre.
|
A partir du calcaire on peut obtenir de la chaux vive CaO.
CaCO3(s) = CaO(s) + CO2(g) sous l'effet de la chaleur. (2).
A 727 °C = 1000 K : DrH°2 =176,2 kJ mol-1 ; P0 = Péquilibre = 0,076 bar.
Calculer l'entropie standard de réaction à ctte température. Pouvait-on prévoir le signe de ce résultat ?
DrG°2 =-RT ln K = -RT ln P0 =-8,314 *1000 *ln 0,076 = 2,14 104 J/mol.
DrG°2 = DrH°2 -T DrS°2 ; DrS°2 = (DrH°2 = DrG°2 ) / T =(176,2 103 -2,14 104) / 1000 ~155 J K-1 mol-1.
Lors
de cette réaction il se forme une grande quantité de dioxyde de
carbone. Le nombre de mole de gaz augmente : le désordre croît ;
l'entropie est positive.
Calculer la pression d'équilibre à 900 °C ou 1173 K. DrH°2 est supposé indépendant de la température.
DrG°2 = DrH°2 -T DrS°2 = 176,2 103 - 1173 *155 = -5,615 103 J mol-1.
ln P = -DrG°2 / (RT) = 5,615 103 /(8,314*1173) = 0,576 ; P = 1,78 bar.
Dans
un récipient initialement vide, de volume V = 50 L, chauffé à 900 °C,
on introduit 80 g de CaO(s), puis on laisse entrer progressivement et
très lentement n moles de CO2(g).
Trouver la valeur minimale de n pour que le système évolue.
Pression de CO2 (g) dans l'état d'équilibre = 1,78 bar ; n(CO2(g)) équilibre= PV / (RT) =1,78 105 *0,050 /(8,314*1173) = 0,913 mol.
A
température constante, en introduisant du dioxyde de carbone
supplémentaire, l'équilibre est rompu ( pour n >0 ) : le
système évolue dans le sens de la consommation du CO2 ajouté, donc dans le sens indirect.
Dans la
situation décrite précédemment, montrer que si n est suffisamment grand
( on précisera la valeur limite correspondante ), il n'y a plus
d'équilibre dans l'état final.
n(CaO(s)initiale = 80 / (40,1 +16 ) = 1,426 mol ; n(CaO(s) équilibre = 0,913 mol.
Il n'y a plus d'équilibre dès que CaO(s) disparaît : n = 0,913 mol.
|
|

