|
|
|
|
Constitution de l'atome.
l'atome d'oxygène a pour symbole 168O. L'ion oxyde s'écrit O2-.
Indiquer le nombre de neutrons, de protons et d'électrons de cet ion.
16-8 = 8 neutrons ; 8 protons et 8+2 = 10 électrons.
Quel est le type de réaction subie par l'élément O pour former l'ion O2- ?
Latome gagne deux électrons pour former l'ion oxyde ; un gain d'électron correspond à une réduction.
Evaluer la masse d'une mole d'atome d'oxygène. Commenter le résultat.
mproton ~mneutron ~1,67 10-27 kg ; mélectron = 9,1 10-31 kg ; NA = 6,02 1023 mol-1.
(16*1,67 10-27 +8*9,1 10-31 )*6,02 1023 =1,61 10-2 kg/mol =16,1 g/mol.
La masse d'un atome est inférieure à la masse de ces constituants isolés et au repos.
Donner l'écriture symbolique de l'atome de cuivre sachant qu'il possède 34 neutrons et que son nombre de masse est 63.
Z = 63-34 = 29 ; A = 63 ; 6329Cu.
Définir "isotopes".
Deux isotopes ne se différencient que par leur nombre de neutrons. Ils possèdent le même numéro atomique Z.
Répondre par vrai ou faux aux propositions suivantes :
Le noyaux de l'atome contient des protons et des électrons. ( faux) ... des protons et des neutrons.
Dans un atome le nombre de protons et toujours égal au nombre d'électrons ( Vrai) ... l'atome est électriquement neutre.
En gagant des électrons un atome se transforme en cation. ( faux) ... en anion négatif.
Un électron porte une charge positive. ( faux ).
L'ion Zn2+ provient d'une oxydation du zinc. ( vrai) ... une oxydation correspond à une perte d'électrons.
Un anion est un atome ayant gagné un ou plusieurs électrons. ( vrai).
Tous les isotopes sont radioactifs. ( faux ).
Donner le symbole chimique des éléments suivants.
Azote N ; mercure Hg ; potassium K ; magnésium Mg.
Donner le nom associé aux symboles suivants.
Na sodium ; Mn manganèse ; Sn étain ; Cd cadmium.
Donner le nom des corps dont les formules sont.
C6H6 benzène ; HNO3 acide nitrique ; D2O eau lourde ; CH4 méthane.
Donner les formules chimiques des produits dont les noms sont :
Sulfate de cuivre CuSO4 ; acide nitreux HNO2 ; acide acétique CH3-COOH ; potasse caustique KOH.
|
Réactions chimiques.
Equilibrer les réactions suivantes :
4CO + Fe3O4 --> 4CO2 + 3Fe.
Cu2S + 2Cu2O --> 6Cu + SO2.
2MnO4- + 5H2SO3 + 6H+ --> 2Mn2+ + 5H2SO4 + 3H2O.
C4H10 + 6,5O2 --> 4 CO2 + 5 H2O.
2S2O32- + I2 --> S4O62- + 2I-.
Le diode est réduit I2 + 2e- = 2I-.
Ecrire l'équation de la réaction acido-basique entre une solution aqueuse d'ammoniac et l'acide chlorhydrique.
NH3aq + H3O+aq + Cl-aq -->NH4+aq + Cl-aq + H2O(l).
|
Solutions, concentrations.
Le propane a pour formule C3H8. Calculer sa masse molaire.
M = 3*12+8 = 44 g/mol.
Une bouteille contient 13 kg de propane.
Calculer la quantité de matière correspondante.
n = m / M = 13 000 /44 =2,9545 102~3,0 102 mol.
On dissout 2 g de pastilles de soude dans 250 mL d'eau.
Calculer la concentration massique ( kg m-3) et molaire ( mol/L) de la solution de soude.
M(NaOH) = 23 +16+1 = 40 g/mol.
n = m / M = 2/40 = 0,05 mol dans 0,25 L ; C = 0,05 / 0,25 =0,2 mol/L.
0,2 *40 = 8 g /L ou 8 10-3 / (10-3) = 8 kg m-3.
Calculer le pH de la solution.
pH d'une base forte : 14 + log C = 14 + log 0,2 =13,3.
On veut préparer un volume V2 = 2 L d'une solution d'ammoniac NH3 de concentration C2 = 0,10 mol/L. On dispose pour cela d'une solution commerciale de concentration C1 = 15,50 mol/L. Quel volume V1 de solution commerciale faut-il prélever ?
Facteur de dilution F = 15,50 / 0,10 = 155.
V1 = V2 / 155 =12,9 ~13 mL.
Chimie organique.
On fait réagir de l'acide heptanoïque C7O2H14 sur de l'éthanol. On obtient un arôme artificiel qui a l'odeur de cognac.
Ecrire la formule semi-développée de l'acide heptanoïque.
CH3-CH2-CH2-CH2-CH2-CH2-COOH
Quel est le groupement fonctionnel caractéristique des acides carboxyliques ?
Groupe carboxyle -COOH.
Ecrire la formule semi-développée de l'éthanol.
CH3-CH2OH.
Ecrire l'équation de la réaction entre l'acide heptanoïque et l'éthanol.
CH3-CH2-CH2-CH2-CH2-CH2-COOH + CH3-CH2OH = CH3-CH2-CH2-CH2-CH2-CH2-COO-CH2-CH3 + H2O.
Répondre par vrai ou faux.
La réaction entre l'acide heptanoïque et l'éthanol s'appelle une estérification. Vrai.
La réaction entre l'acide heptanoïque et l'éthanol s'appelle une saponification. Faux.
La réaction inverse d'une estérification est une saponification. Faux. ... une hydrolyse de l'ester.
La réaction inverse d'une estérification est une réacvtion d'hydrolyse. Vrai.
|
Connaissance du matériel.
Nommer le matériel ci-dessous et indiquer succinctement son usage.
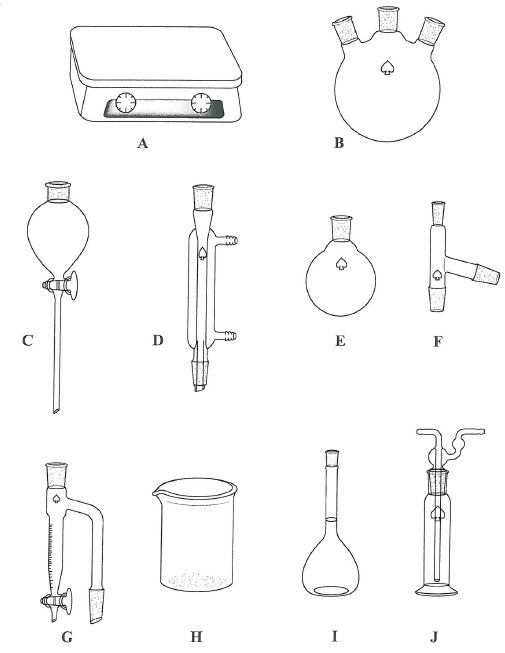
A : balance de précision, pesée d'un solide ou d'un liquide.
B : ballon tricol, synthèse organique.
C : ampoule à décanter, séparation de deux liquides non miscibles.
D : réfrigérant à eau, condensation des vapeurs lors d'une distillation ou d'un chauffage à reflux.
E : ballon col rodé, distillation sous vide.
F : tête de distillation utilisé dans une distillation ou une hydrodistillation
G : un tube décanteur permet de séparer l’eau formée du reste du milieu réactionnel, par
distillation.
H : becher, mesure peu précis d'un volume.
I : fiole jaugée, mesure précis d'un volume.
J : flacon de garde, situé entre la fiole et la trompe à eau, pour empêcher les retours d'eau vers la fiole à vide.
|
|
