Dosage de l'acide
ascorbique : titrages acido-basique et oxydo-réduction, Capes 2014.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
L'étiquette
du médicament est reproduite :
Sulfate ferreux :172,73 mg soit fer : 50 mg
acide ascorbique ( vitamine C) : 30 mg
magnésium carbonate ; talc ; silice ; amidon de maïs ; enveloppe de la
gelule : gélatine, titane dioxyde, bleu patenté, jaune de quinoléïne.
Le professeur désire déterminer la quantité d'acide ascorbique contenu
dans la gélule de Timoférol. Il retient deux méthodes classiques de
dosage adaptées à la classe de terminale S : un titrage acide-base et
un titrage d'oxydo-réduction.
Le
protocole de dissolution d'une gélule de Timoférol proposé aux élèves
est le suivant :
Placer le contenu d'une gélule dans une fiole jaugée de 100,0 mL.
Ajouter de l'eau distillée au 3/4 de la fiole et agiter.
Compléter au trait de jauge avec de l'acide sulfurique concentré.
Titrage
acido-basique.
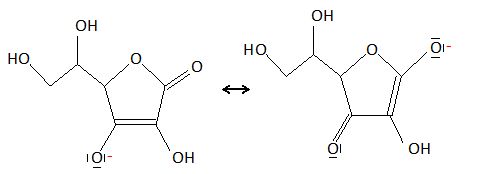
L'acide ascorbique AscH2 est un acide faible.
Donner la
représentation topologique de sa base conjuguée en justifiant la réponse.
L'ion ascorbate est stabilisé par résonance.
proposer une solution titrante adaptée. ( Indiquer sa composition et proposer une valeur pour sa concentration, en justifiant succinctement les choix ).
M(C6H8O6) = 6*12+8+6*16 =176 g/mol.
Quantité de matière d'acide ascorbique contenu dans une gélule : 0,030 / 176 = 1,7 10-4 mol.
La gélule est dissoute dans de l'eau distillée ( fiole jaugée de 100 mL
). La concentration en acide ascorbique est alors : 1,7 10-4/0,10 = 1,7 10-3 mol/L.
Une solution de soude de concentration 2,0 10-3 mol/L peut convenir : le volume ajouté à l'équivalence sera ( pour une prise de 10 mL d'acide ascorbique ) : Véq = 10*1,7 10-3 / (2,0 10-3) =8,5 mL.
Cette valeur est assez grande, tout en restant inférieure à 25 mL, volume de la burette graduée contenant la soude.
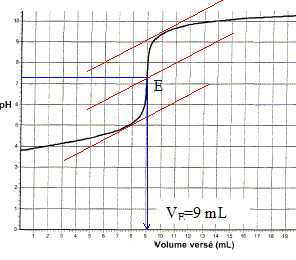
Ecrire l'équation de la réaction de titrage et proposer une méthode pour déterminer expérimentalement le volume équivalent.
AscH2aq + HO-aq ---> AscH-aq + H2O(l).
Suivi pHmétrique ou utiliser un indicateur coloré acido-basique ( BBT).
Pourquoi le professeur ne retient-il finalement pas cette méthode pour doser l'acide ascorbique dans la gélule ? La dissolution de la gélule ( principes actifs et excipients) doit être réaliser en milieu acide sulfurique.
Pratiquer ensuite un dosage acido-basique conduirait à doser l'acide sulfurique ( en large excès ) et l'acide ascorbique.
|
|
|
Titrage d'oxydo-réduction.
La seconde méthode proposée est un titrage d'oxydoréduction de l'acide ascorbique AscH2 par une solution d'ions triiodure I3-.
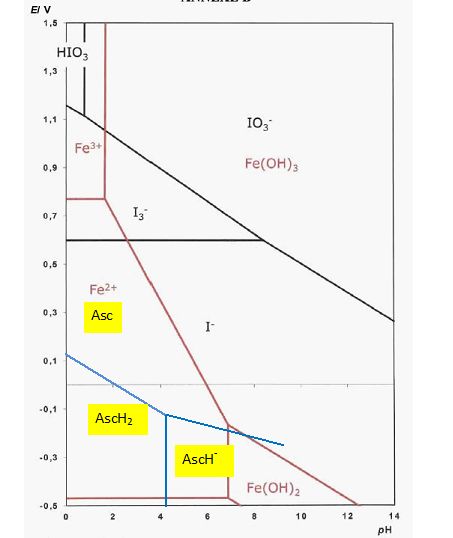
Sur le diagramme fourni, tracer
le diagramme potntiel-pH des espèces dérivées de l'acide ascorbique en
y plaçant les domaines de prédominance des espèces Asc, AscH- et AscH2. ( les concentrations totales en espèces dissoutes sont 0,10 mol/L).
E°( Asc / AscH2) = 0,13 V à 25°C ; pKa(AscH2/AscH-) = 4,2.
pH< 4,2.
Asc+2H++2e- = AscH2.
Equation de Nernst : E = 0,13 + 0,03 log [Asc][H+]2 / [AscH2].
E = 0,13 -0,06 pH + log [Asc] / [AscH2]
Equation de la droite frontière : E = 0,13 -0,06 pH.
pH= 4,2.
La droite frontière verticale sépare les domaines de AscH2 et AscH-.
pH > 4,2.
Asc+H++2e- = AscH-.
Equation de Nernst : E = E°(Asc/AscH-) + 0,03 log [Asc][H+] / [AscH-].
E = E°(Asc/AscH-) -0,03 pH + log [Asc] / [AscH-]
Equation de la droite frontière : E = 0,13 -0,03 pH.
|
.
|
|
Justifier la pertinence du choix de la solution titrante et écrire l'équation de la réaction du titrage.
La différence des potentiel standard des couples (Asc /AscH2) et ( I3-/I-) est proche de 0,5 V.
Oxydation de l'acide ascorbique, réducteur le plus fort : AscH2 = Asc + 2H+ + 2e-.
Réduction de l'ion I3-, oxydant le plus fort : I3- +2e- = 3I-.
Bilan : AscH2 + I3- = Asc + 2H+ +3I-.
Pourquoi ce titrage doit-il être effectué en milieu acide ?
Il y a dismutation en milieu basique de I3- en ion iodure et en ion IO3- .
|
La présence d'ion Fe2+ pose-t-elle problème ? Justifier.
Les domaines de prédominance des ions Fe2+ et I3- ont une partie commune en milieu acide. La présence d'ion fer II ne pose pas problème.
La
réalisation pratique de ce titrage conduit à une difficulté : la
texture de la solution de Timoférol s'épaissit lors de l'addition de la
solution titrante et prend une couleur violacée.
Proposer une explication en consultant l'étiquette du Timoférol.
L'un des excipients est l'amidon de maïs.
En présence d'empois d'amidon, le diiode donne une coloration violet foncée à la solution.
|
|