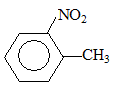
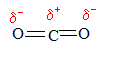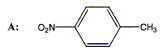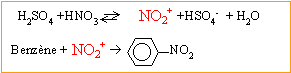|
|
|
|
Le programme de
terminale S aborde les grandes catégories de réaction de la chimie
organique et la notion de mécanisme réactionnel.
Proposer
aux élèves un exemple concret illustrant chacune des catégories de
réaction en précisant les conditions expérimentales.
Réaction de
substitution.
Au cours d'une réaction de substitution, un atome ou un groupe d'atomes
est remplacé par un autre atome ou par un autre groupe d'atomes. On
observe la rupture d'une liaison et la reformation simultanée ou non
d'une autre liaison.
Exemple :
Le
substrat est un dérivé halogéné, noté R-X. Le réactif HO-
est un nucléophile ( qui a une affinité pour les noyaux, zones
déficientes en électrons ).
R-X + HO- = R-OH + X-.
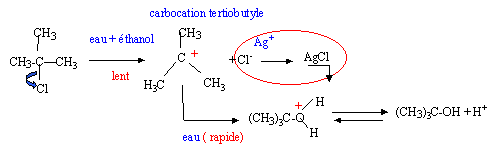
Réaction d'addition.
Au moins deux molécules se combinent pour en former une autre, plus
grande. Les composés chimiques doivent posséder des liaisons multiples.
Exemple :
addition de dihydrogène sur un alcène en présence de nickel de Raney.
Hydrogène ( gaz) et catalyse hétérogène : cis addition.

Réaction d'élimination.
L'élimination se produit en
présence d'une base forte et en chauffant le
mélange réactionnel.
Elimination E2
bimoléculaire :
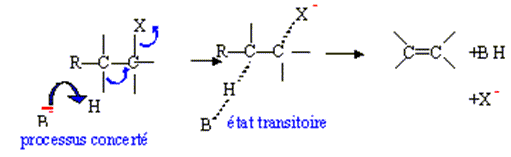
Elimination
E1
monomoléculaire :
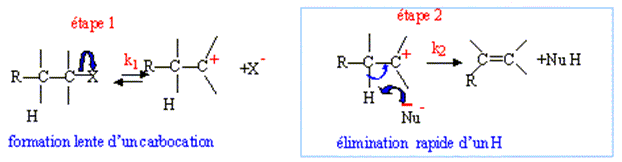
|
.
Le document suivant
propose deux mécanismes réactionnels extraits d’une copie d’élève.
Identifier
les mécanismes réactionnels abordés et les erreurs
éventuellement commises par cet élève. Proposer un corrigé précis de la
copie avec d’éventuels conseils à donner à l’élève.
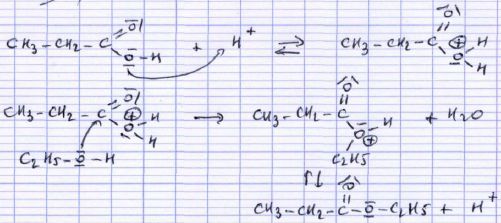
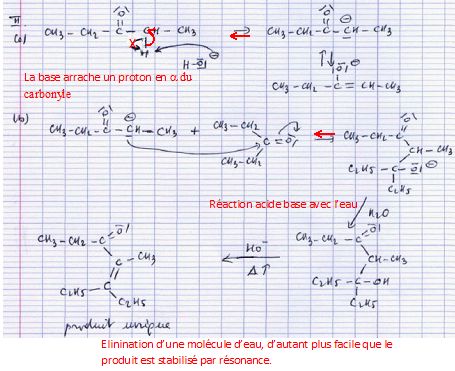
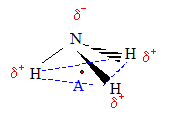
Chaque
étape du mécanisme réactionnel correspond des mouvements de doublets
d'électrons traduisant la formation ou la rupture de liaisons. Ce
déplacement de
doublet d'électron est représenté par une flèche courbe allant du site
donneur
d'électron vers le site accepteur.
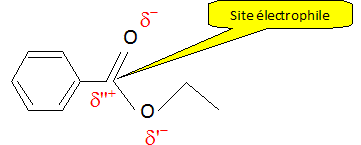
Mécanisme de l'estérification :
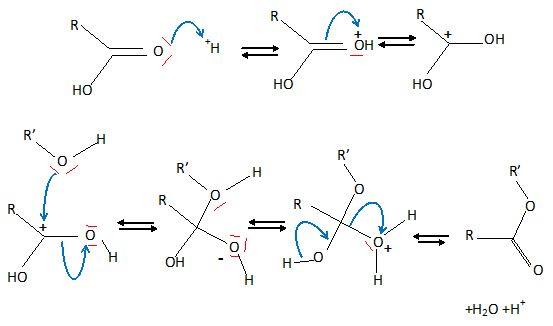
|
|