|
Etude spectrophotométrique d'une solution aqueuse de sulfate de nickel : concours kiné Berck 2012. |
||||||||
| .
. |
||||||||
|
||||||||
|
.
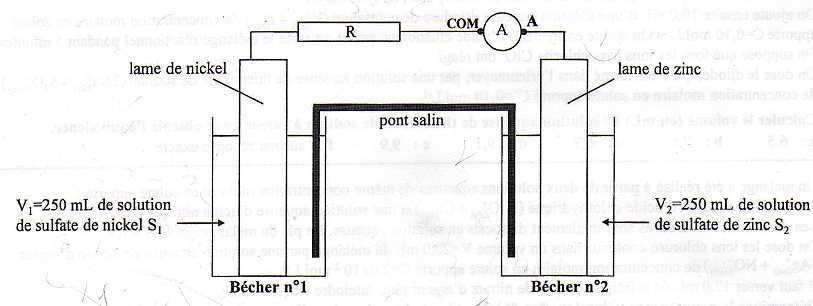
On prépare une solution S1 de sulfate de nickel en dissolvant une masse de 16,9 g de sulfate de nickel heptahydraté solide NiSO4,7H2O dans de l'eau distillée pour obtenir 500 mL de solution. La solution S1 ainsi préparée a une concentration molaire en soluté apporté notée c1. Dans le becher n°1, on verse un volume V1 =250 mL de la solution aqueuse de sulfate de nickel S1 de concentration c1 et on y plonge une lame de nickel. On mesure la valeur de l'absorbance de la solution de sulfate de nickel contenue dans le becher n°1 au bout de Dt et on trouve A =0,978. On donne F =9,65 104 C mol-1. Couples oxydant / réduteur Ni2+aq /Ni(s) ; Zn2+aq /Zn(s).
.
Déterminer la concentration molaire c1 ( en mmol /L ) de la solution S1. M(NiSO4, 7H2O) =58,7 +32,1 +64 +7*18 =280,8 g/mol. n(NiSO4, 7H2O) =n(Ni2+) =16,9 / 280,8 =6,0185 10-2 mol. c1 =n(Ni2+) / V =6,0185 10-2 /0,5 =0,1204 ~0,12 mol/L~120 mmol/L. Déterminer la concentration molaire [Ni2+]f ( en mmol /L ) de le becher n°1 au bout de Dt. On dilue 10 fois la solution S1 avant mesure de l'absorbance. A = k c1 /10 ; k = 10A / c1 =2,32 /0,1204= 19,274 L mol-1. [Ni2+]f = Af / k = 0,978 / 19,274 =5,074 10-2 mol/L ~50,7 mmol /L. Déterminer l'intensité ( en A) lue sur l'ampèremètre, pendant le fonctionnement de la pile. Quantité de matière d'ion nickel II ayant disparu : (c1 -[Ni2+]f ) V1 =(0,120-0,0507)*0,250 =1,7325 10-2 mol. Ni2+aq + 2e- = Ni(s). Quantité de matière d'électrons : n(e-) = 2 n(Ni2+aq). Quantité d'électricité Q = IDt = n(e-) F ; I = n(e-) F / Dt=2*1,7325 10-2 *9,65 104 / (3600 +37*60) =0,57452 ~0,575 A. Or l'ampèremètre est monté en sens inverse ( borne COM sur la borne positive de la pile, la lame de nickel ), on lit donc -0,575 A.
|
||||||||
|
|
||||||||