.
|
|
On vous demande de déterminer la structure d’une molécule A à l’aide des analyses qui ont été effectuées.
L’analyse par spectrométrie de masse par impact électronique
conduit à un spectre dans lequel on observe les pics suivant :
m/z
|
39
|
43
|
77
|
78
|
91
|
121
|
122
|
164
|
intensité relative (%)
|
17
|
20
|
45
|
53
|
12
|
100
|
63
|
72
|
Que pouvez-vous en déduire sur la masse moléculaire de A ?
Le pic moléculaire est à m/z = 164 ; M = 164 g/mol.
Dans le cas où l’analyse aurait été effectuée par ionisation chimique en utilisant comme gaz réactant NH3, les pics observés auraient-ils été les mêmes ?.
L'ionisation
électronique conduit à un ion radical qui peut ensuite se fragmenter.
Le spectre est assez fourni avec de nombreux fragments.
L'ionisation chimique, suite à des réactions ions-molécules produit principalement des ions [MH]+ permettant d'accéder à la masse moléculaire de l'espèce analysée. L'ionisation est douce et il y a peu de fragments.
L’analyse centésimale de A est la suivante :
C = 73,17 % ; H = 7,31 % ; O = 19,51 %
Déduisez-en la formule brute de A. Formule brute CxHyOz avec x, y et z entiers.
12 x / 73,17 = M/100 = 164/100 = 1,64 d'où x = 1,64 *73,17/12 =10.
y = 7,31 / 1,64 d'où y = 1,64*7,31 =12
16 z / 19,51 = 1,64 d'où z = 19,51*1,64/16 = 2. C10H12O2.
L’analyse par spectrométrie RMN 1H et 13C permet d’observer les pics suivants :
1H déplacement chimique (ppm)
|
2,11
|
3,61
|
3,76
|
6,85
|
7,10
|
|
multiplicité
|
singulet
|
singulet
|
singulet
|
doublet
|
doublet
|
intégration
|
3 H
|
2 H
|
3 H
|
2H
|
2H
|
| 13C déplacement chimique (ppm) |
29,1
|
50,1
|
55,2
|
114,2
|
130,4
|
158,7
|
206,8
|
D’après le spectre 1H, pensez-vous que A puisse comporter un groupement éthyle (CH2-CH3) ? Justifiez votre réponse.
Un groupe éthyle donnerait un triplet pour les protons de CH3 et un quadruplet pour les protons CH2 ; or cela n'est pas observé : le groupe éthyle n'est pas présent.
Sachant que le spectre 1H a été mesuré à une fréquence de 250 MHz, convertissez les valeurs des déplacements chimique, données en ppm, en Hertz.
ppm
|
2,11
|
3,61
|
3,76
|
6,85
|
7,10
|
Hz
|
2,11*250 =527
|
3,61*250 =902
|
940
|
1712
|
1775
|
|
| .
. |
Le spectre 13C comprend 8 pics. Comparez cette valeur avec le nombre de carbone dans la molécule A. Que pouvez-vous en déduire ?
La molécule compte 10 atomes de carbone et le spectre seulemnt 8 pics :
certains atomes de carbones ont le même environnement.
Quel type de fonction chimique peuvent être attribués les pics de déplacement chimique 6,85 et 7,10 ppm en RMN 1H et 114,2, 126,3, 130,4 et 158,7 en RMN 13C ?
6,85 et 7,10 ppm en RMN 1H : protons benzéniques ou protons éthyléniques ou proton du groupe phénol.
114,2, 126,3, 130,4 en RMN 13C : cycle aromatique ou hétéroaromatique ou carbone éthylénique.
158,7 en RMN 13C : hétéroaromatique ou ester.
L’analyse par spectrométrie IR conduit à différents pics qui ont été identifiés comme suit :
nombre d'onde ( cm-1)
|
3000
|
2936
|
1711
|
1612-1500
|
1350
|
1300
|
liaison
|
Csp2-H
|
Csp3-H |
C=O cétone
|
C=C aromatique
|
Csp3-H |
C-O
|
nature
|
valence
|
valence valence
|
valence
|
valence
|
déformation
|
valence
|
Comment procéderiez-vous pour effectuer cette analyse si A est un liquide ? Un solide ?
Les échantillons liquides peuvent être placés entre deux plaques d'un sel très pur ; les plaques sont transparentes à la lumière infrarouge.
Pour un solide : moudre finement l'échantillon avec du bromure de
potassium très pur ; ce mélange poudreux est comprimé dans une
presse afin d'obtenir une pastille translucide.
Déduisez de l’ensemble des informations récoltées deux structures possibles de A.
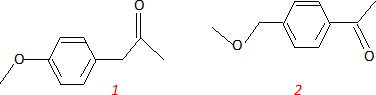
Sachant que l’un des produits de départ permettant la synthèse
de A est le 1-bromo-4-méthoxybenzène, appelé également 4-bromoanisole, déduisez-en la structure exacte de A.
Structure 1.
.
