|
Dilution, chromatographie, conductimétrie : concours ATPL interne 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
||||||||
| .
. |
||||||||
|
||||||||
|
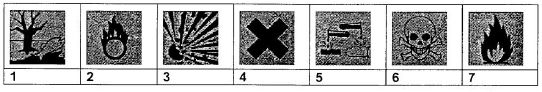 Indiquer sur les étiquettes suivantes les pictogrammes de sécurité nécessaires en utilisant les nombres ci-dessus correspondants. 
Sur un flacon d'ammoniac on lit : densité d = 0,95 ; pourcentage massique en ammoniac 30% ; M(NH3) = 17 g/mol. Pour préparer 500 mL de solution d'ammoniaque de concentration 1 mol/L, il faut prélever : 29,9 mL ; 17,9 mL ; 59,8 mL; 5,58 10-2 mL ; 8,97 mL de solution commerciale. Concentration de la solution commerciale : Masse de 1 L : 0,95 kg = 950 g ; masse d'ammoniaque pure : 950*0,30 = 285 g soit 285/17 = 16,76 moles d'ammoniac dans 1 L. Facteur de dilution F = 16,76 / 1 = 16,76 ; volume de solution commerciale à prélever : 500 / 16,76 = 29,8 mL. Une solution d'eau oxygénée commerciale titre à 110 volumes. On donne à 25 °C : Vm = 24 L/mol ; 2H2O2aq ---> 2H2O(l) + O2(g). La concentration de cette solution commerciale vaut : ( en mol/L ) 9,17 ; 18,34 ; 4,58. n(O2) = 110 / 24 = 4,583 mol pour 1 L de solution commerciale. n(H2O2aq) =2 n(O2) = 2*4,583 = 9,17 mol/L. Après avoir réalisé l'extraction de l'huile essentielle d'orange par hydrodistillation, on vérifie sa composition à l'aide d'une chromatographie sur couche mince. L'éluant est constitué d'un mélange à 9 volumes de cyclohexane pour 1 volume d'acétone. Pour réaliser la préparation de 200 mL d'éluant, il faut mélanger : A) 10 mL d'acétone et 90 mL de cyclohexane ; B) 90 mL d'acétone et 10 mL de cyclohexane ; C) 180 mL d'acétone et 20 mL de cyclohexane ; D) 20 mL d'acétone et 180 mL de cyclohexane ( vrai ). Pour s'assurer qu'une huile essentielle contient du limonène et du citral on procède à une chromatographie sur couche mince. Sur une plaque de silice imprégnée de substance sensible au rayonnement ultra-violet on effectue les dépôts suivants : C : citral ; L : limonène ; H : huile essentielle. Parmi les chromatogrammes ci-dessous, quel est celui qui convient ? 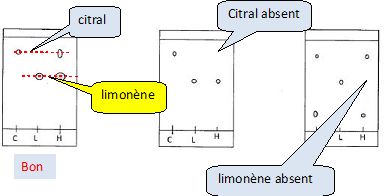 Les taches sont incolores. Citer deux façons de procéder pour les mettre en évidence. Exposition à la lumière UV ; utiliser un révélateur : diiode, permanganate de potassium.
|
||||||||
|
|
||||||||