Les
minerais de limonite et de garniérite sont mélangés avec de l'eau,
criblés et broyés pour former une boue appelée pulpe. Le minerai mis en
pulpe est préchauffé à la vapeur et injecté en continu dans un
autoclave avec une solution aqueuse d'acide dulfurique, c'est la
lixiviation. La haute température dans l'autoclave ( 270°C) permet
d'accélérer cette extraction et ainsi de traiter une plus grande
quantité de minerai.
|
|
En
contrepartie, cette haute température exige d'opérer sous haute
pression. Justifier.
La pulpe, le milieu réactionnel doit rester sous forme liquide.
Dans le minerai, le nickel est sous forme d'oxyde de nickel.
Ecrire l'équation de
la réaction se produisant lors de la lixiviation de NiO(s) par l'acide
sulfurique H2SO4 en solution aqueuse.
NiO() + H2SO4 = Ni2+aq + SO42-aq
+ H2O(l).
La pulpe "lixiviée" qui est ainsi obtenue contient des solides (
principlement des oxydes de fer et hydroxydes de fer ) et une solution
aqueuse où se trouvent des ions issus de divers métaux dont le nickel
et le cobalt mais aussi d'autre métaux non récupérables pour
l'exploitation ( magnésium, aluminium, chrome, zinc, cuivre...).
Rechercher,
à 298 K, dans quel domaine de pH il faut se placer pour que plus
de 99 % de sions fer(III) soient précipités sous forme d'hydroxyde de
fer (III° sans qu'il y ait formation d'hydroxyde de nickel ou de cobalt
(II).
On fera les calculs dans le cas où 1 L de la solution de lixiviation
contient 1,0 10-2 mol d'ion Ni2+, 1,0 10-3
mol d'ion Co2+ et 1,0 10-1 mol d'ions Fe3+.
pKs(Fe(OH)3))
= 38,6 ; pKs(Ni(OH)2)) = 14,7
; pKs(Coi(OH)2)) = 14,2.
[Fe3+] inférieur ou égal à 0,10 /100
= 1,0 10-3 mol/L en solution aqueuse.
[Fe3+][HO-]3 =
10-38,6 ; [HO-] = (10-38,6/ 1,0 10-3)1/3 =1,36 10-12
mol/L ;
[H3O+] = 10-14 /(1,36 10-12
) = 0,0074 mol/L ; pH =2,1.
A pH supérieur à 2,1, 99% des ions fer(III) sont sous forme Fe(OH)3)s.
[Ni2+][HO-]2 =
10-14,7 ; [HO-] = (10-14,7/ 0,010)1/2 =4,47 10-7
mol/L ;
[H3O+] = 10-14 /(4,47 10-7
) = 2,24 10-8 mol/L ; pH =7,65 ~7,7.
A pH supérieur à 7,7 Ni(OH)2s précipite.
[Co2+][HO-]2 =
10-14,2 ; [HO-] = (10-14,7/ 0,0010)1/2 =1,41 10-6
mol/L ;
[H3O+] = 10-14 /(1,41 10-6
) = 7,1 10-9 mol/L ; pH =8,1.
A pH supérieur à 8,1 Co(OH)2s précipite.
On se place dans l'intervalle de pH : [2,1 ; 7,6 ].
le solide est séparé de la solution liquide appelée " liqueur mère".
préciser les deux
techniques de sépparation qui sont abordées au collège en classe de
cinquième.
La décantation et
la filtration.
Précisez l'objectif
visé par le programme.
Introduire la notion de mélanges homogène et hétérogène. Répondre à la
question " Comment obtenir de l'eau limpide ?".
Proposer
une démarche d'investigation permettant d'atteindre l'objectif visé et
préciser la situation déclenchante.
L'eau d'un puits a-t-elle toujours le même aspect après des pluies
importantes, qui durent plusieurs jours ?
Comparer l'aspect de l'eau à l'arrivée et à la sortie d'une
station d'épuration.
Le probléme d'accès à l'eau potable et le traitement des eaux usées dan
un pays en voie de développement.
|
La
liqueur mère est neutralisée par ajout de calcaire et de chaux. Elle
contient encore, en plus du nickel et du cobalt, du zinc et du
manganèse, ainsi que du calcium et du magnésium. Elle est alors traitée
dans une série d'extractions. La solution utilisée pour l'extraction
est constituée d'un hydrocarbure comme solvant contenant de l'acide de
di(2-éthylhexyl) phosphorique, représenté ci-dessous et noté AH.
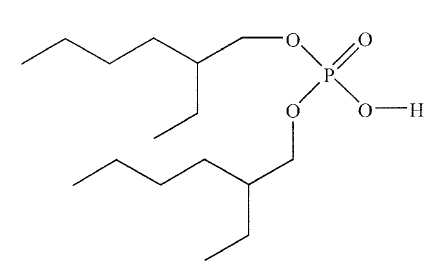
Expliquer
pourquoi cet acide existe sous forme de dimère dans le solvant
organique et représenter la structure du dimère en notant R le groupe
2-éthylhexyl .
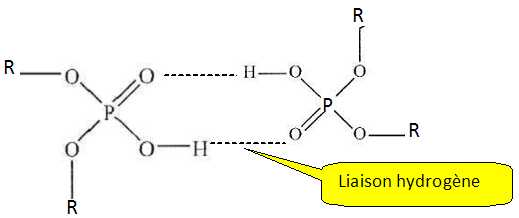
L'équilibre de dimérisation s'écrit : 2 HA org = (HA)2 org.
(1) ; "org" signifie en phase organique.
La constante d'équilibre est KD = 1,0 104.
Calculer
la fraction de l'acide di(2-éthylhexyl) phosphorique qui s'est
transformé en dimère, lorsque la concentration initiale est c0
=5,0 10-2 mol/L.
K = [(HA)2 org ]/ [HA org]2 ; c0 =2[(HA)2
org ] + [HA org] = 2K [HA org]2 + [HA org].
On note x = [HA org] : 2 Kx2 + x -c0 = 0 ;
2,0 104x2 + x -5,0 10-2 = 0
; D = 1 + 4000 = 4001
; D½ =63,25.
x = (-1 + 63,25)/ 4,0 104) ~1,56 10-3. [HA org] =
1,56 10-3 mol/L et [(HA)2 org ]= 4,84 10-2
mol/L.
[HA org] / c0 = 1,56 10-3 / 5,0 10-2
= 3,1 10-2 ( 3,1 %) ; [(HA)2 org ] / c0
=96,9 %.
Autre méthode :
|
avancement volumique (mol/L) |
2 HA org |
= (HA)2 org. |
| initial |
0 |
c0 |
0 |
| en
cours |
x |
c0-2x |
x |
| fin |
xéq |
c0-2xéq |
xéq |
K =xéq / (c0-2xéq)2
; (c0-2xéq)2 = xéq /
K ; (0,05 -2xéq)2 = 10-4 xéq.
4x2éq +0,052 -4*0,05 xéq- 10-4
xéq=0 ; 4x2éq +2,5 10-3
-0,2001 xéq +2,5 10-3=0 ; D = 4,004 10-2 -4,0 10-2
= 4,001 10-5 ; xéq =(0,2001 -6,325 10-3)
/ 8 =2,42 10-2 mol/L.
c0-2xéq= 1,56 10-3 mol/L.
Lors de
l'extraction d'un cation métallique noté M2+ de la solution
aqueuse, il se produit la réaction :
M2+aq + 2(HA)2 org = M(HA)2)2org
+ 2H+aq. (2).
"aq" signifie en phase aqueuse et "org" en phase organique.
Pour tester l'efficacité de la séparation entre les ions Co2+
et Ni2+, on réalise l'expérience suivante :
Une solution aqueuse tamponée à pH = 5,0, de volume Va =
10,0 mL contient des ions Co2+ et Ni2+aux
concentrations initiales respectives CCo = 1,5 10-3
mol/L et CNi = 1,0 10-2 mol/L.
On extrait avec un volume Vo =5,0 mL de la solution
organique contenant l'acide di(2-éthylhexyl) phosphorique de
concentration c0 = 0,050 mol/L.
On analyse la phase aqueuse après extraction, on mesure alors des
concentrations en ions cobalt et nickel respectives : [Co2+]
=2,1 10-4 mol/L et [Ni2+] = 5,3 10-3
mol/L.
Calculer la fraction
des ions Ni2+ et celle des ions Co2+ extraites
par la phase organique.
CCo -[Co2+]
=1,5 10-3 -2,1 10-4 =1,29 10-3 mol/L ;
1,29 10-3 / 1,5 10-3 =0,86.
CNi -[Ni2+] =1,0 10-2 -5,3 10-3
= 4,7 10-3 mol/L ; 4,7 10-3 / 1,0 10-2
=0,47.
En
supposant que l'acide HA non complexé est totalement sous forme de
dimère en phase organique, calculer la constante de l'équilibre
d'extraction (2), K°2, dans le cas où le cation est Ni2+.
K°2 =[H+aq]2[M(HA2)2org] / ([M2+aq][(HA)2 org]2).
Conservation de l'élément nickel : CNi Va
= [Ni2+] Va+[Ni(HA)2)2org]Vo ;
[Ni(HA)2)2org] = (CNi-[Ni2+] ) Va / Vo=( 1,5 10-3-5,3 10-3)*10/5 = 9,4 10-3
mol/L.
Conservation de
l'élément cobalt : CCo Va = [Co2+]
Va+[Co(HA)2)2org]Vo ;
[Co(HA)2)2org] = (CCo-[Co2+] ) Va / Vo=( 1,5 10-3 - 2,1 10-4)*10/5 = 2,58 10-3
mol/L.
Conservation de A : c0Vo =2 [ (HA)2
org] Vo+4 [Ni(HA)2)2org] Vo +4 [Co(HA)2)2org] Vo ;
[ (HA)2 org] = ½c0 -2[Ni(HA)2)2org] -2[Co(HA)2)2org]
[ (HA)2 org] =0,5 *0,05 -2(9,4 10-3 +
2,58 10-3)
=1,04 10-3 mol/L.
[H+aq] = 10-5 mol/L ; K°2 =10-10
*9,4 10-3/((1,04
10-4)2*5,3 10-3) =1,6 10-4.
Les ions
sont ensuite extraits de la phase organique par une phase aqueuse
d'acide chlorhydrique.
Justifier le passage
quantitatif des ions vers la phase aqueuse.
En milieu acide, pH inférieur à
5, l'équilibre (2) est déplacé dans le sens indirect.
Après plusieurs cycles
d'extactions et des passages sur des résines échangeuses d'ions, on
obtient une solution de chlorure de nickel (II) et une solution
de chlorure de cobalt (II). La solution de chlorure de nickel est
chauffée à haute température ( 800°C ), on obtient de l'oxyde de nickel
(II). La solution de chlorure de cobalt (II) est traitée par ajout de
carbonate de sodium ; il se forme une pulpe de cristaux ce carbonate de
cobalt (II). Après décantation et filtration, on récupère un gâteau
pourpre.
Ecrire
les équations des réactions qui permettent de modéliser les
transformations chimiques décrites.
Ni2+aq + 2Cl-aq
+H2O= NiO(s) + 2HCl(g).
Co2+aq + 2Cl-aq +2Na+aq
+CO32-aq= CoCO3(s) + 2Na+aq +2Cl-aq.
|
|

