Un
amateur d'aréomodélisme souhaite protéger des rayures les pièces en
aluminium présentes dans son modèle réduit d'avion. Pour cela, il
utilise un traitement de surface qui consiste à anodiser l'aluminium afin de le durcir. En effet une couche d'alumine Al2O3
de très faible épaisseur recouvre naturellement l'aluminium mais cette
couche fine est sujette à la détérioration. L'anodisation consiste à
oxyder en surface la pièce en aluminium ; la couche d'alumine ainsi
formée est plus épaisse et garantit une plus grande dureté.
|
|
Couples oxydant / réducteur : Al2O3(s) /Al(s) ; O2(g) / H2O(l) ; H+aq / H2(g).
NA = 6,02 1023 mol-1 ; e = 1,6 10-19 C ; M(Al2O3) = 102 g/mol ; r(Al2O3) = 4,0 g cm-3.
Principe de l'anodisation.
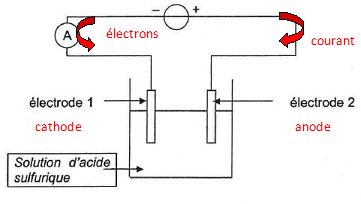
La pièce d'aluminium propre est utilisée comme anode de l'électrolyse d'une solution aqueuse d'acide sulfurique ( 2H+aq + SO42-aq)
de concentration molaire en soluté apporté c =2,0 mol/L. La cathode est
constituée d'une barre de graphite. On utilise un générateur de tension
et un ampèremètre.
Indiquer le sens conventionnel du courant et le sens de circulation des électrons.
Un dégagement gazeux se produit à la cathode.
Ecrire
la demi-équation (1) d'oxydo-réduction expliquant cette observation en
utilisant l'un des couples cités. Justifier le choix de ce couple.
Une réduction se produit à la cathode négative. L'oxydant de l'un des
couple conduit à un gaz, le réducteur de ce même couple. Seul le
couple H+aq / H2(g) convient.
2H+aq + 2e- = H2(g). (1).
L'aluminium doit être oxydé. Indiquer l'emplacement du graphite et celui de la pièce.
Une oxydation se produit à l'anode positive ( pièce en aluminium ) ; une réduction a lieu à la cathode négative ( graphite).
Ecrire la demi équation (2) relative au couple Al2O3(s) /Al(s).
2Al(s) + 3H2O= Al2O3(s) + 6H+aq + 6e- (2).
En déduire que l'équation d'oxydo-réduction de la réaction d'électrolyse est .
2Al(s) + 3H2O= Al2O3(s) + 3H2(g).
Multiplier (1) par 3 et ajouter à (2) :
6H+aq + 6e- = 3H2(g).
2Al(s) + 3H2O + 6H+aq + 6e- = 3H2(g) + Al2O3(s) + 6H+aq + 6e-.
Simplifier l'écriture : 2Al(s) + 3H2O= Al2O3(s) + 3H2(g).
S'agit-il d'une transformation spontanée ou forcée ? Justifier.
L'électrolyse est une transformation forcée, nécessitant un apport d'énergie sous forme électrique.
|
.
Etude quantitative de l'électrolyse.
La surface de la pièce à anodiser est S = 9,0 cm2. L'intensité du courant est maintenue à I = 120 mA pendant la durée Dt = 18 min.
Exprimer la quantité de matière d'électrons échangés en fonction de I, Dt, NA et e.
Quantité d'électricité Q = I Dt = n(e-) NA e ; n(e-) = I Dt / (NA e).
Quelle relation existe-t-il entre la quantité de matière d'alumine formée et n(e-) ?
2Al(s) + 3H2O= Al2O3(s) + 6H+aq + 6e- (2).
n(Al2O3) = n(e-)/ (6NA e) M(Al2O3).
Montrer que la masse maximale d'alumine formée est : m = IDt / (6NA e) M(Al2O3). Calculer sa valeur.
m = n(alumine) M(Al2O3) = n(e-) M(Al2O3) / 6 ;
m = I Dt / (6NA e) M(Al2O3).
m = 0,120 * 18*60 / (6*6,02 1023*1,60 10-19) *102 =2,2873 10-2 ~2,3 10-2 g.
Le rendement r de l'électrolyse est de 90 %.
En déduire la masse d'alumine réellement formée.
2,2873 10-2 *0,90 = 2,059 10-2 ~2,1 10-2 g.
L'amateur souhaite obtenir une couche d'alumine d'une épaisseur minimale d = 7,0 µm sur toute la surface.
Calculer le volume V' d'alumine à déposer.
V' = S d = 9,0 * 7,0 10-4 = 6,3 10-3 cm3.
Déterminer la masse m' correspondante.
m' = V' r(Al2O3) = 5,147 10-3 *4,0 =2,52 10-2 ~2,5 10-2 g.
L'épaisseur minimale d'alumine souhaitée n'est pas obtenue.
Quels paramètres de l'électrolyse peut-il modifier pour augmenter la quantité d'alumine déposée ?
L'intensité du courant et la durée de l'électrolyse peuvent être augmentées.
|
|
