.
|
|
On donne les couples oxydant réducteur : C3H6O / C3H8O et HCrO4- / Cr3+.
Ecrire les demi-équations électroniques puis l'équation de la réaction.
Oxydation : 3 fois { C3H8O = C3H6O + 2H+ +2e- }
Réduction : 2 fois { HCrO4- +3e- + 7H+ = Cr3++4H2O }
Ajouter : 3C3H8O +2HCrO4- +6e- + 14H+= 3C3H6O + 6H+ +6e- +2Cr3++8H2O.
Simplifier : 3C3H8O +2HCrO4- + 8H+= 3C3H6O +2Cr3++8H2O.
Expérience 1 : température T et volume V du milieu réactionnel sont constants ; concentrations initiales :
alcool C1 0 = 0,080 mol/L ; hydrogénochromate C0 2 = 1,08 10-3 mol/L.
On mesure la concentration de l'ion hydrogénochromate C2 au cours du temps :
t(min)
|
0
|
10
|
20
|
30
|
40
|
50
|
60
|
80
|
C2 (mmol/L)
|
1,08
|
0,851
|
0,671
|
0,529
|
0,417 |
0,329 |
0,259 |
0,161 |
Xvol ( mmol/L)
½(C0 2 -
C2 )
|
0
|
0,115
|
0,205
|
0,276
|
0,332
|
0,376
|
0,411
|
0,460
|
Etablir le tableau d'avancement et en déduire le réactif limitant.
|
avancement (mol)
|
3C3H8O |
+2HCrO4- |
+ 8H+ |
= 3C3H6O |
+2Cr3+ |
+8H2O |
début
|
0
|
C1 0 V |
C0 2 V |
excès
|
0
|
0
|
solvant
|
en cours
|
x
|
C1 0 V-3x |
C0 2 V-2x |
3x
|
2x
|
fin
|
xf
|
C1 0 V-3xf |
C0 2 V-2xf |
3xf
|
2xf
|
|
Si C3H8O est en défaut : C1 0 V-3xf =0 ; xf =C1 0 V/3 = 0,027 V mol.
Si HCrO4- est en défaut : C2 0 V-2xf =0 ; xf =C2 0 V/2 = 5,4 10-4 V mol.
On retient la plus petite valeur : HCrO4- est le réactif limitant.
On appelle avancement volumique le rapport x/V = Xvol.
Etablir la relation entre Xvol, C2 0 et C2.
C2 =(C0 2 V-2x) / V = C0 2 -2x/V = C0 2 -2Xvol.
Compléter le tableau ci-dessus en calculant Xvol aux différentes dates et tracer la courbe Xvol = f(t).
Xvol = ½(C0 2 -
C2 ).
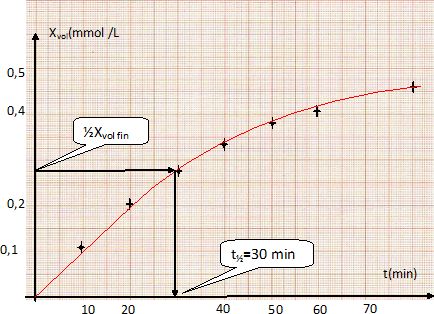
Définir le temps de demi-réaction t½ et déterminer sa valeur.
Le temps de demi-réaction est la durée au bout de laquelle l'avancement est égal à la moitié de l'avancement final.
Xvol f =C2 0 /2 = 5,4 10-4 mol = 0,54 mmol.
|
.
Expérience 2 : température T et volume V du milieu réactionnel sont constants ; concentrations initiales :
alcool C1 0 = 15 mmol/L ; hydrogénochromate C0 2 = 10 mmol/L.
On mesure la concentration de l'ion chrome (III) au cours du temps :
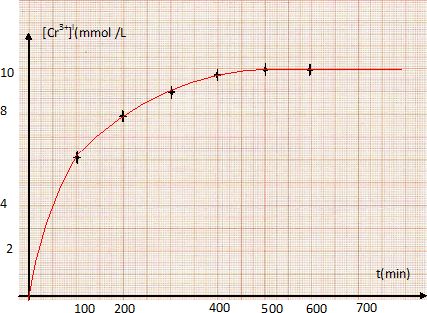
Quel est le réactif limitant ? Quelles seront les concentrations finales des réactifs ?
Si C3H8O est en défaut : C1 0 V-3xf =0 ; xf =C1 0 V/3 = 5,0 V mmol.
Si HCrO4- est en défaut : C2 0 V-2xf =0 ; xf =C2 0 V/2 = 5,0 mmol.
Les réactifs sont en proportions stoechiométriques. les réactifs sont
entièrement consommés; leurs concentrations finales sont nulles.
Quelle est la durée approximative de la seconde expérience ?
Le graphe conduit à environ 500 min.
|
|
|

