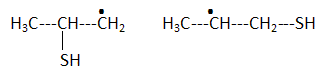|
Obtention
de composés soufrés en chimie organique :
concours
Caplp maths sciences 2011 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||
| .
. |
|||||||
|
|||||||
|
Les espèces H2S, HS- et S2- sont utilisées en chimie organique pour synthétiser des composés soufrés.  Les thiols possèdent en général une forte odeur : ils sont responsables de l'odeur de l'urine après ingestion d'asperges, de l'odeur de l'ail, de l'oignon... et sont mêmes utilisés dans la fabrication des "boules puantes" des magasins de farces et attrapes. Cette aprtie ne fait appel à aucune connaissance particulière sur la chimie organique du soufre. On rappelle par ailleurs que la chimie des alcools et des thiols est très similaire. Comparer la basicité puis la nucléophilie des ions HO- et HS-. Justifier. A 25°C : pKa ( H2O/HO-) = 14 ; pKa ( H2S/HS-) = 12,9. A concentration égale, la base la plus forte correspond au plus grand pKa : HO- est une base plus forte que HS-. Basicité au sens de Lewis et nucléophilie : La basicité ( phénomène thermodynamique : équilibre entre une base et son acide conjugué ) Une base est une espèce susceptible de céder un doublet. La nucléophilie ( phénomène cinétique : mesure de la vitesse d'une réaction entre unnucléophile et un électrophile) Aptitude d'une espèce à attaquer un site déficitaires en électrons. La basicité est la nucléophilie varient souvent dans le même sens. Comparaison entre plusieurs nucléophiles : - Influence de la charge : pour le même atome, l'espèce anionique est plus nucléophile que la forme neutre (OH- plus nucléophile que H2O) - Influence du numéro atomique : sur une même période ( même ligne du tableau périodique), la nucléophilie diminue de gauche à droite, du fait de l'électronégativité croissante Dans une même colonne, la nucléophilie croît de haut en bas : HS-est plus nucléophile que HO-. -Influence du solvant : les solvants polaires protiques diminuent la nucléophilie par formation de liaisons hydrogènes avec les anions. Les solvants polaires aprotiques (DMSO, DMF, ethers) augmentent la nucléophilie des anions. - l'encombrement stérique fait décroire la nucléophilie.
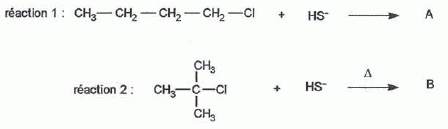
On
considère les réactions suivantes : Donner le nom du composé chloré de la réaction 2. 2-chloro-2-méthylpropane. Que peut-on dire sur B à partir du test à l'eau de brome ? L'eau de brome est décolorée en présence d'un alcène ; B possède une liaison double carbone-carbone. Expliciter les formules semi-développées ou topologiques de A et B ? 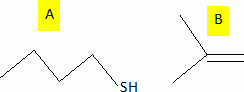 Donner le nom des réactions 1 et 2 ? Réaction 1 : SN2, substitution nucléophile bimoléculaire. Réaction 2 : élimination monomoléculaire. Formation lente d'un carbocation tertiaire stable, suivie d'une réaction acide base rapide. Proposer un mécanisme réactionnel permettant de justifier la formation de A. 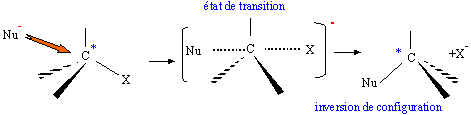 On considère les réactions suivantes : 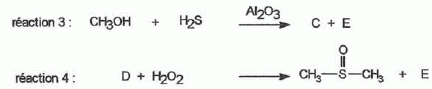 Indiquer les doublets non liants de la sulfoxyde de la réaction 4. En déduire une géométrie VSEPR pour la sulfoxyde. 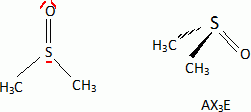 Expliciter les formules semi-développées ou topologiques des composés C, D et E. C : CH3SH ; E : H2O ; D : CH3-S-CH3. A quelle famille de réaction de la chimie organique appartient la réaction 4 ? Oxydation d'un thioéther en sulfoxyde. Quel est le rôle de l'alumine ? L'alumine joue le rôle de catalyseur. Le composé D est un sous-produit de la réaction 3. Proposer une explication pour sa formation. L'ion RS- est un nucléophile susceptible d'effectuer des réactions de substitution : RS-+ ROH = R-S-R +HO-.
H2S peut s'additionner sur les alcènes comme le but-1-ène.  L'enthalpie de réaction dans le cas de l'obtention du composé a vaut -76 kJ mol-1 alors que dans le cas du composé ß elle vaut + 67 kJ mol-1. On peut orienter la réaction vers la formation prépondérante d'un des deux composés en modifiant les conditions opératoires. Par exemple : 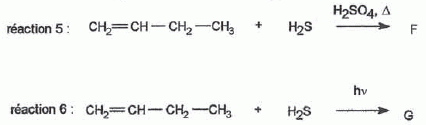 Les composés a et ß possèdent-ils des stéréoisomères ? Si oui, représenter les différents stéréoisomères en représentation de Cram autour du carbone porteur de la fonction thiol et déterminer les configuration absolues des carbones asymétriques en justifiant. Le composé ß ne possède pas de carbone asymétrique, donc pas d'énantiomères. Le composé a possède un atome de carbone asymétrique et possède deux énantiomères. 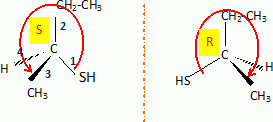 Quel serait le composé prépondérant dans le cas d'un équilibre entre a et ß ? Toute réaction mène en premier au produit formé le plus aisément ( sous contrôle cinétique). Dans ce cas l'isomère a. Dans le cas où on laisse le temps à l'équilibre entre a et ß s'établir, le composé le plus stable ß deviendra prépondérant ( contrôle thermodynamique ). On donne le profil réactionnel d'une réaction chimique en deux étapes. 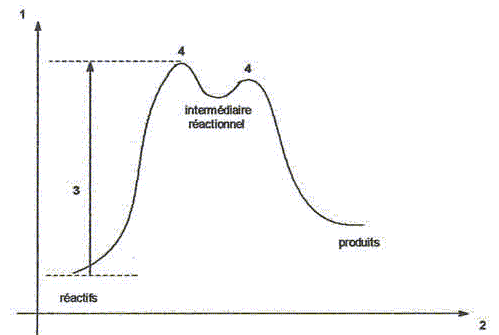 Identifier les grandeurs 1 à 3 et l'état 4 sur le schéma. 1 : énergie libre ; 2 : avancement de la réaction ; 3 : énergie d'activation ; 4 : complexe activé. Quelle est l'étape cinétiquement déterminante ? La première étape, formation d'un carbocation, rupture d'une liaison est lente, cinétiquement déterminante. Elle possède la plus grande énergie d'activation. La seconde est rapide. Rappeler le postulat de Hammond. A une faible variation d'énergie dans une molécule, correspond une faible modification de structure. L'état de transition est structurellement proche de la molécule dont le niveau énergétique est le plus proche du sien. Dans une réaction exothermique, l'état de transition est proche de la molécule de départ ; dans une réaction endothermique, l'état de transition est proche de la molécule finale. On suppose que le profil énergétique est celui des réactions 5 et 6. Dans le cas de la réaction 5, l'intermédiaire réactionnel est un carbocation du propène formé par réaction de H+ sur le propène. Donner les formules semi-développées des deux cations susceptibles de se former. Lequel est le plus stable ? Un carbocation secondaire est plus stable qu'un carbocation primaire. 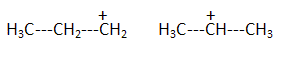 Sachant que les deux carbocations sont des intermédiaires réactionnels possibles, identifier l'intermédiaire réactionnel se formant le plus rapidement. En déduire le composé F de la réaction 5. L'énergie d'activation de l'étape 1 est plus élevée que celle de l'étape 2 ; une réaction endothermique est favorisée par une élévation de température. L'état de transition est plus proche de la structure finale. F est le composé ß.
|
|||||||
| |
|||||||
|
|