|
QCM
chimie : concours agrégation Algérie
2001 En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|||||||
| .
. |
|||||||
|
|||||||
|
La réaction d'estérification est une réaction chimique : A. qui se produit entre un acide carboxylique et un alcool ; B. qui se produit entre un acide minéral et un alcool ; C. dont le rendement diminue des alcools primaires aux alcools tertiaires ; D. lente et de rendement inférieur à l'unité. Analyse : Réaction lente, limitée par l'hydrolyse de l'ester, se produisant entre un acide carboxylique et un alcool ; pour un mélange initial équimolaire, le rendement est de 65 % pour un alcool primaire, 60 % pur un alcool secondaire et 5 % pour un alcool tertiaire. Donc réponses A, C et D. La vitesse v d'une réaction chimique à un instant t : A. est égale à la dérivée en fonction du temps de l'avancement x de la réaction ; B. est de signe contraire à celui de la vitesse de formation d'un produit ; C. est une constante négative ; D. est dans certains cas proportionnelle à dC/dt avec C la concentration.. Analyse : v = 1/V dx/dt, avec V volume de la solution. Si ce volume est constant v = dC/dt. La vitesse est toujours positve et diminue en général au cours du temps ( sauf autocatalyse ). Donc B et D. Considèrons deux solutions aqueuses d'acides faibles de même concentration C telle que 10-6 mol/L < C < 0,1 mol/L. La solution qui correspond à l'acide le plus fort : A. est celle qui a la valeur du pH la plus grande ; B.est celle qui a la valeur du pH la plus petite ; C. est celle qui a la valeur du pKa la plus grande ; D. est celle qui a la valeur du pKa la plus petite. Analyse : A concentration égale, l'acide le plus fort possède le plus petit pKa et le plus petit pH. Donc B et D. Soit la pile symbolysée par Pb| Pb2+(C1) || Cu2+(C2) | Cu L'équation de la réaction qui lui est associée : A. Pb2++ Cu --> Pb + Cu2+ ; B. Pb + Cu2+ --> Pb2++ Cu ; C. Pb + Cu --> Pb2++Cu2+ ; D. Pb2++Cu2+ --> Pb + Cu. Analyse : Le plomb s'oxyde et constitue la borne négative Pb(s) = Pb2+ + 2e-; les ions cuivre (II) sont réduits à la cathode positive Cu2++ 2e-= Cu(s) : donc B.
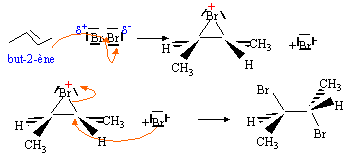
A. E = E° +0,03 log [Cu2+] / [Zn2+] ; B. E = E° -0,03 log [Cu2+] / [Zn2+] ; C. E = E° +0,03 log [Zn2+] / [Cu2+] ; D. E = E° -0,03 log [Zn2+] / [Cu2+] . Analyse : Le zinc s'oxyde et constitue l'anode négative Zn(s) = Zn2+ + 2e-; E1 = E°1 + 0,03 log [Zn2+]. Les ions cuivre (II) sont réduits à la cathode positive Cu2++ 2e-= Cu(s) ; E2 = E°2 + 0,03 log [Cu2+]. E =E2 - E1 =E°2 -E°1 + 0,03 log [Cu2+]- 0,03 log [Zn2+] ; donc A et D. On a P = [Ba2+][SO42- ] et Ks le produit de solubilité. A. cette réaction est observée lorsque P< Ks ; B. cette réaction est observée lorsque P> Ks ; C. cette réaction est lente ; D. cette réaction est instantanée. Analyse : Réaction rapide qui se produit dès que [Ba2+][SO42- ] est supérieur ou égal à Ks ; donc B et D. A. la vitesse de la réaction augmente avec la température ; B. la vitesse de cette réaction ne varie pas avec la température ; C. la vitesse de la réaction augmente si la concentration initiale [B]0 augmente ; D. la vitesse de la réaction augmente si la concentration initiale [A]0 augmente. Analyse : La vitesse d'une réaction chimique augmente, en général, avec la température. Les concentrations des réactifs sont un facteur cinétique ; donc A, C et D. L'hydratation du propène CH3-CH=CH2 donne comme produit majoritaire : A. le propan-2-ol ; B. le propan-1-ol ; C. le propanal ; D. la propanone ( acétone). Analyse : Règle de Markovnikov : le groupe OH se fixe sur le carbone de la double liaison le plus substitué. Donc A. En solution aqueuse, un acide est d'autant plus faible que : A. sa base conjuguée est faible ; B. la valeur de son pKa est élevée ; C. sa concentration C est forte ; D. le produit ionique de l'eau est faible. Analyse : A un acide faible correspond une base forte et un pKa élevé; donc B. A. dans un atome, deux électrons ne peuvent avoir leurs quatre nombres quantiques égaux ; ils différent au moins par s ( +½ ou -½) ; B. dans un atome, deux électrons différent toujours par leur nombre quantique de spin s ; C. dans un atome, les 4 nombres quantiques de deux électrons sont tous différents les uns des autres ; D. dans un atome, les 4 nombres quantiques de deux électrons, peuvent dans certains cas prendre la même valeur. Analyse : deux électrons ne peuvent pas se trouver dans le même état quantique ; donc A. A. est une fonction décroissante de la dilution ; B. est une fonction croissante de la dilution ; C. indépendante de la dilution ; D. une fonction croissante ou décroissante de la dilution suivant la nature de l'électrolyte. Analyse : La dilution augmente la dissociation de l'acide ou la protonation de la base ; donc B.
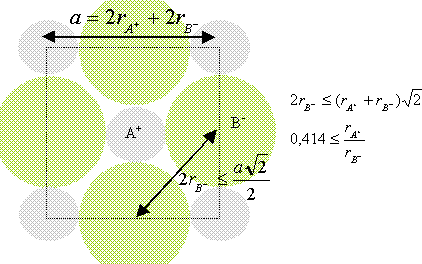
Lewis a défini un acide comme un composé susceptible de : A. libérer un proton au cours d'une réaction chimique ; B. accepter des électrons d'un donneur, la base au cours d'une réaction chimique ; C. mettre en commun son doublet d'électrons lors d'une réaction chimique ; D. libérer des électrons à un accepteur, la base. Analyse : Un acide de Lewis présente un doublet électronique vacant, c'est un accepteur de doublet ; donc B. A. 4 atomes : un pour les atomes aux sommets et 3 pour les atomes aux centres des faces ; B. 6 atomes : 2 pour les atomes aux sommets et 4 pour les atomes aux centres des faces ; C. 10 atomes : 4 pour les atomes aux sommets et 6 pour les atomes aux centres des faces ; D. 14 atomes : 8 pour les atomes aux sommets et 6 pour les atomes aux centres des faces. Analyse : Chaque atome situé aux sommets du cube appartient à 8 cubes et compte pour 1/8è ; chaque atome situé au centre des faces appartient à deux cubes et compte pour ½ ; il y a 8 sommets et 6 faces ; donc A. La compacité ou densité de remplissage est défini comme le rapport du volume occupé par les particules, au volume de la maille. Dans un réseau cubique centré, la compacité est donnée par : A. p 3½ / 8 ; B. p 2½ / 6 ; C. p / (3 x 2½ ) ; D. p 3½ / 4. Réponse A. A 25°C le pH d'une solution aqueuse est égal à 2 ; la concentration en ion oxonium vaut ( en mol/L) : A. 0,01 ; B. 0,02 ; C. 0,2 ; D. 2. Analyse : [H3O+] = 10-pH = 10-2 = 0,01 mol/L ; donc A. A 25°C, le pKa du couple H3O+ / H2O vaut : A. 0 ; B. 7 ; C. 14 ; D. 1. Réponse A. L'hydrolyse d'un ester en milieu basique : A. conduit toujours à un équilibre chimique ; B. est totale ; C. est impossible car elle ne peut se faire qu'en milieu acide ; D. produit un anhydride d'acide. Analyse : L'hydrolyse basique ( ou saponifiacation ) d'un ester est lente et totale ; donc B. Quand on passe des alcools primaires aux alcools tertiaires, la mobilité de l'hydrogène dans le groupe OH : A. augmente suite à l'encombrement stérique du groupement R ; B. décroît à cause de l'électronégativité de l'atome d'oxygène ; C. ne dépend pas de la classe d'alcool ; D. décroît à cause de l'effet inductif du groupement R. Analyse : L'hydrogène du groupe OH est d'autant plus mobile ( acide) que la charge négative de la base conjuguée R-O- est répartie sur un plus grand nombre d'atomes ; or le groupe R, par effet inducteur donneur renforce la charge négative portée par l'atome d'oxygène donc D.
|
|||||||
| |
|||||||
|
|