|
Chimie organique : l'oseltamivir, l'acide (-) shikimique : bts chimiste 2011. En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts. |
|||||||||||||||
| .
. |
|||||||||||||||
|
|||||||||||||||
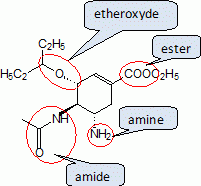
Partie 1 ; l'oseltamivir.Indiquer le nom des quatre fonctions chimiques présentes dans la molécule d'oseltamivir. |
|
|
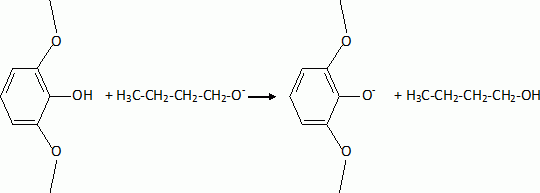
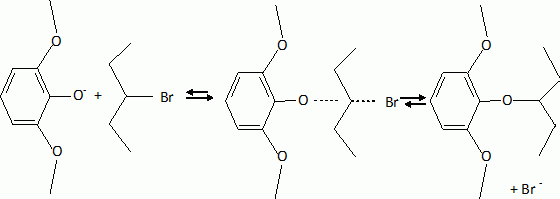
L'étape suivante est la monobromation de C par le dibrome. Indiquer la formule de C. Justifier l'orientation de la réaction. La bromation se fait ici sans catalyseur parce que le composé B est beaucoup plus réactif que le benzène. Indiquer un catalyseur ( nom et formule ) utilisé habituellement dans ce type de réaction. Les trois substituants du cycle benzénique sont des donneurs d'électrons par effet mésomères. La position 4 est la plus activée pour une substitution électrophile du cycle benzénique. 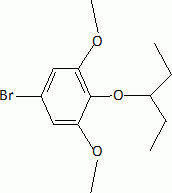 |
L'acide shikimique.
Etude structurale :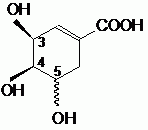
Le nom officiel de l'acide (-) shikimique est : acide (3S, 4R, 5S)-3, 4, 5-trihydroxy-1-cyclohexènecarboxylique.
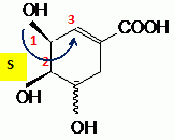
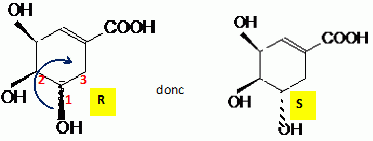
Préciser sur l'exemple du carbone 3, comment déterminer la configuration absolue indiquée.
Numéroter de façon décroissante
chacun des quatre substituants selon son numéro
atomique. On place alors l'atome (ou le groupement) de
numéro le plus élevé
derrière.
On regarde dans quel sens, sens horaire ou
trigonométrique, on passe du numéro 1, au 2,
au 3.
- Si le sens de rotation est le sens horaire (ou
anti-trigonométrique), le carbone est Rectus (R),
- Si le sens de rotation est le sens
trigonométrique (ou anti-horaire), le carbone est
Sinister (S).
 |
 |
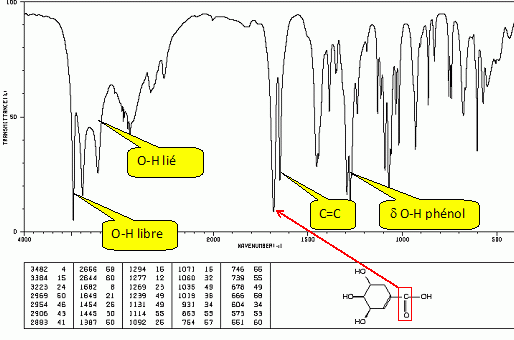
|
|
L'acide (-) shikimique peut être également obtenu par voie de synthèse à partir du (E, E)-1,4-diacétoybuta-1,3-diène :

Ce diester est chauffé dans le toluène à
Donner la formule semi-développée de l'acide prop-2-éne.
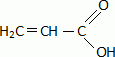
On rappelle la réaction de Diels-Alder du buta-1,3-diène avec l’éthylène (ou éthène) :
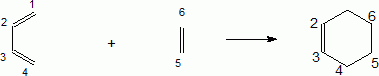
Recopier sur la copie le schéma de la réaction de Diels-Alder en l'appliquant aux composés étudiés. Donner la structure de F.
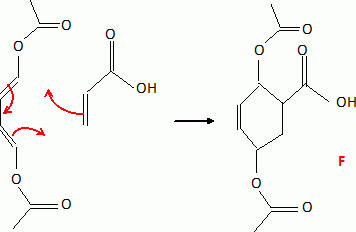
Pourquoi obtient-on un mélange avant recristallisation ?
Le stéréoisomère endo se forme le plus rapidement. Le composé exo est
le plus stable thermodynamiquement. L'équilibre est déplacé en sa
faveur si on laissse la réaction se prolonger un certain temps.
La fonction acide carboxylique du composé F est transformée par action du diazométhane CH2N2 dans l'éthoxyéthane en un composé G qui fournit ensuite H.
Ecrire la formule de Lewis du diazométhane.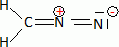
Ecrire la réaction du diazométhane avec un acide carboxylique.
CH2N2 + RCOOH = RCOO-CH3 + N2.
Donner la formule semi-développée de G.
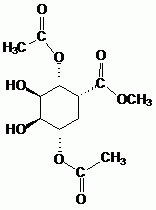 |
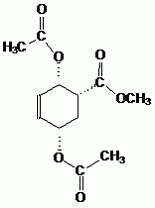 |
Proposer une méthode pour transformer G en H. Hydroxylation d'un alcène par OsO4 en diols cis. |
| H |
G |
|
|
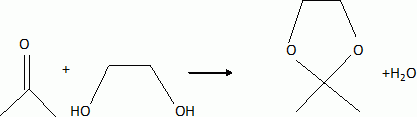
H est alors agité dans l'acétone en présence d'acide paratoluènesulfonique pour fournirI ( C15H22O8). Rappeler l'équation de la réaction de l'acétone avec l'éthan-1, 2-diol en milieu acide.
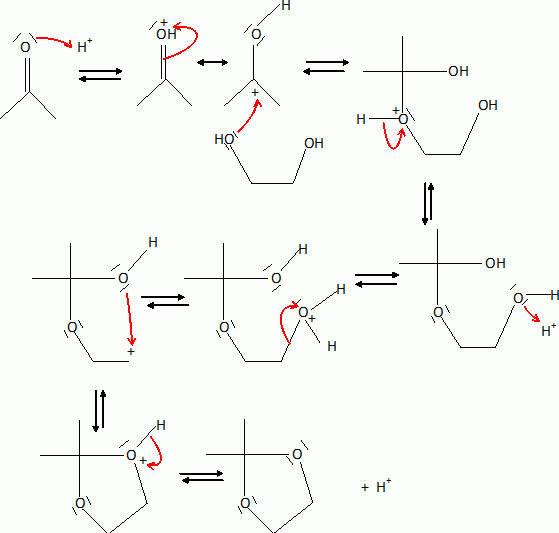 |
|
|
Donner la formule semi-développée de I.
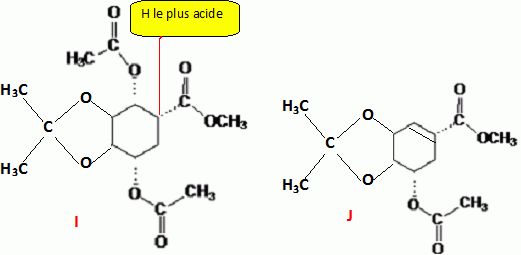
I chauffé dans l('thoxyéthane en présence d'une base non nucléophile, fournit J( C13H18O6).
Identifier l'atome d'hydrogène le plus acide de I et en déduire J.
J est chauffé dans une solution aqueuse acidifiée puis saponifié à température ambiante et on obtient après passage en milieu acide l'acide shikimique.
Indiquer la nature et l'intérêt des différentes réactions mises en jeu dans cette transformation.
En milieu acide on passe de l'acétal au glycol ( déprotection de la fonction diol cis ).
La saponification ( hydrolyse basique) des deux esters donne un alcool et un ion carboxylate.
En milieu acide ( réaction acide base) on passe de l'ion carboxylate à l'acide carboxylique.