|
Hydrolyses des esters : bac S Amérique du Nord 2011. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
L'hydrolyse des esters conduit à un état d'équilibre chimique pour lequel coexistent un acide carboxylique, un alcool, un ester et l'eau. Lors d'une hydrolyse basique, le réactif utilisé est une solution d'hydroxyde de sodium par exemple. L'équation générale d'une réaction d'hydrolyse basique est : 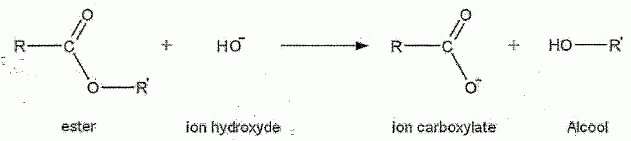 L'ion carboxylate, contrairement à l'acide carboxylique formé lors de l'hydrolyse avec l'eau, est sans effet sur l'alcool de sorte que la réaction inverse d'estérification n'a pas lieu. Une application de l'hydrolyse basique est l'obtention de savons. En effet, les réactions de saponification ne sont autres que des réactions d'hydrolyse basique à partir de corps gras qui sont des triesters du glycérol. Les savons, obtenus par précipitation de l'ion carboxylate formé, sont des carboxylates de sodium ou de potassium. Ces derniers composés sont moins solubles dans l'eau salée que dans l'eau. L'éthanoate de benzyle CH3-COO-CH2-C6H5 est un ester très parfumé extrait du jasmin. On recueille un échantillon presque pur que l'on fractionne en deux parties égales. On donne la formule semi-développée de l'alcool benzylique : 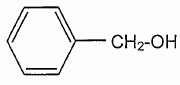 et la masse molaire M de l'éthanoate de benzyle M = 150 g/mol. et la masse molaire M de l'éthanoate de benzyle M = 150 g/mol.Hydrolyse d'un ester. La première partie de l'échantillon précédent est introduite dans un ballon avec une quantité de matière égale d'eau et quelques gouttes d'acide sulfurique concentré. Ce ballon, équipé d'un chauffage à reflux, est placé au bain marie. La constante d'équilibre K de la réaction d'hydrolyse qui se produit est égale à 0,25. Ecrire en utilisant les formules semi-développées, l'équation de la réaction et nommer les produits formés. 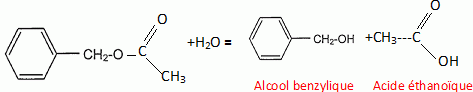 Donner deux caractéristiques de cette réaction. L'hydrolyse d'un ester est lente et limitée par la réaction inverse, l'estérification.
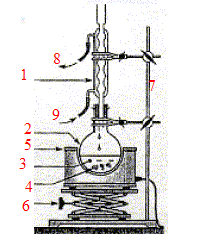
1-
réfrigérant droit à eau ; 2 -ballon ;
3- mélange réactionnel ; 4- pierre ponce ; 5-
chauffe ballon ; 6- élévateur à
croisillons ; 7- tige support ; 8- sortie de l'eau ; 9-
arrivée de l'eau. On note n0 les quantités de matière initiales de réactifs et xf l'avacement final de la réaction.
Taux d'avancement : x / xmax. Dans l'état final : x = xf et xmax = n0. Le taux d'avancement final t vaut : t = x / xmax = xf / n0. Donner l'expression de la constante d'équilibre K et montrer que K = t2 / (1-t)2. K = [acide éthanoïque]f [alcool benzylique]f / ([ester]f [eau]f ). K =(xf / (n0-xf))2 =( t n0 / (n0-t n0))2 =( t / (1-t ))2. Vérifier que le rendement de la réaction est voisin de 33 %. 0,25 = ( t / (1-t ))2 ; 0,5 = t / (1-t ) ; 0,5 -0,5 t = t ; t = 0,5 / 1,5 = 0,33 ( 33 %). Comment évolue le rendement de la réaction lorsqu'on extrait l'alcool du milieu réactionnel ? En éliminant l'un des produits au fur et à mesure de sa formation, on déplace l'équilibre dans le sens direct. Le rendement augmente jusqu'à atteindre 100 %.
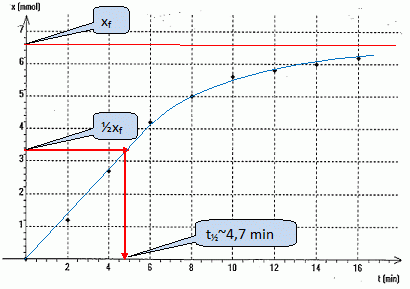
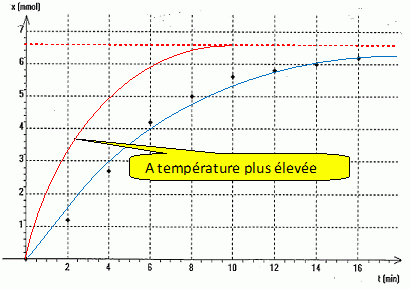
Hydrolyse basique d'un ester : On fait réagir la seconde partie de l'échantillon avec une solution aqueuse d'hydroxyde de potassium en excès. Le volume V du mélange réactionnel obtenu est égal à 200 mL. Par dosage de prélevements successifs de 20,0 mL, on détermine la quantité de matière d'ion hydroxyde restant n(HO-) restant à différentes dates ainsi que l'avancement x de la réaction d'hydrolyse basique.
En exploitant le texte, donner l'interêt d'une hydrolyse basique. L'hydrolyse basique est totale. La réaction inverse, l'estérification, ne peut pas se produire : l'ion carboxylate est sans effet sur l'alcool. Ecrire la relation entre n(HO-) restant et l'avancement x de la réaction à la date t. n(HO-) restant = n(HO-) initial -x. En déduire les valeurs manquantes du tableau. x(t=4) = n(HO-) initial -n(HO-) restant = 10 -7,3 = 2,7 mmol. x(t=6) = n(HO-) initial -n(HO-) restant = 10 -5,8 = 4,2 mmol. La masse d'éthanoate de benzyle utilisée est égale à 10,0 g. Déterminer la valeur finale xf de l'avancement. Quantité de matière initiale d'ester : m / M = 10,0 / 150 = 6,67 10-2 mol dans 200 mL soit 6,67 10-3 mol dans chaque prélevement de 20 mL. La réaction est totale et l'hydroxyde de potassium est en excès ; l'ester est donc le réactif limitant : xf =6,67 10-3 mol.
Obtention d'un savon. Pour obtenir un savon, on réalise à chaud l'hydrolyse basique du tributyrate de gmycéryle ou butyrine avec une solution d'hydroxyde de potassium. Pour récupérer le savon on effectue une opération de relargage. On notera R-COOH l'acide butyrique. Ecrire la formule semi-développée du glycérol ainsi que celle de la butyrine. 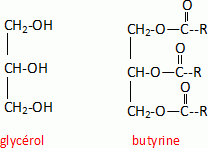 Quel est l'interêt de l'opération de relargage, qui consiste à ajouter de l'eau salée au milieu réactionnel ? Les ions carboxylates du savon sont bien moins solubles dans l'eau salée que dans l'eau : en conséquence le savon précipite et peut être isolé du milieu réactionnel par filtration. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|