|
Titrage
des ions nitrate dans un engrais :
bac S Nlle Calédonie 2010 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
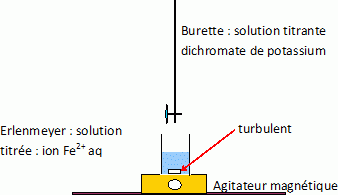
Dans le sol, l'azote est présent sous forme d'ions nitrate NO3- (aussi appelé azote nitrique) ou d'ions ammonium NH4+ (azote ammoniacal). Aujourd'hui, les engrais azotés permettent l'apport de ces ions en fonction des besoins de la plante. L'utilisation de ces engrais doit être controlée. En effet, les ions nitrate sont peu retenus par le sol et sont entrainés dans les eaux superficielles (lacs, rivières ... ) et dans les eaux souterraines (nappes phréatiques). Une trop forte concentration en ions nitrate dans l'eau peut avoir des conséquences graves sur la santé des consommateurs. Dans cet exercice, on se propose de déterminer le pourcentage massique en azote nitrique d'un engrais azoté et de comparer la valeur trouvée à l'extrait d'étiquette donnée : 24 % d'azote (N) total dont 11% d'azote uréique, 6 % d'azote nitrique, 7 % d'azote ammoniacal. La détermination de ce pourcentage est obtenue par titrage des ions nitrate de cet engrais. Protocole expérimental. Une masse m = 2,5 g d'engrais liquide est placée dans une fiole jaugée de 250 mL. On complète la fiole jusqu'au trait de jauge par de l'eau distillée : on obtient une solution notée (S). Dans un erlenmeyer, on introduit un volume Va = 25,0 mL de la solution d'engrais précédente (S) puis un volume V1 = 20,0 mL d'une solution de sel de Mohr de concentration en ions fer (II) : [Fe2+] = 0,20 mol/L. Un ajout de 5 mL d'acide sulfurique permet d'acidifier le mélange. L'ensemble est porté à une douce ébullition car la réaction est lente. Les ions nitrate de l'engrais réagissent de façon totale avec les ions fer (II) de la solution de sel de Mohr selon la réaction d'équation : NO3-aq +3Fe2+aq +4H3O+aq = NO(g) +3Fe3+aq + 6H2O(l). (1)
L'équation de la réaction de titrage des ions fer (II) en excès par les ions dichromate s'écrit :
Exploitation des résultats. On note : - ni (Fe2+) la quantité de matière initiale en ions fer (II) dans l'erlenmeyer ; - nR(Fe2+) la quantité de matière en ions fer (II) réagissant dans la réaction 1 avec les ions nitrate ; - nex (Fe2+) la quantité de matière en ions fer (II) en excès ; nE (Cr2O72-) : la quantité de matière en ions dichromate versée à l'équivalence. Exprimer nR(Fe2+)) en fonction de ni (Fe2+) et nex (Fe2+). ni (Fe2+) = nR(Fe2+) + nex (Fe2+) ; nR(Fe2+) = ni (Fe2+) - nex (Fe2+). Titrage des ions fer (II) en excès. Définir l'équivalence d'un titrage. A l'équivalence, les quantités de matière des réactifs sont en proportions stoechiométriques. Avant l'équivalence, l'un des réactifs est en excès, après l'équivalence, l'autre réactif est en excès. En complètant le tableau d'avancement de la réaction 2, montrer que la quantité de matière en ions fer (II) en excès nex (Fe2+) dans l'erlenmeyer s'exprime par: nex (Fe2+) = 6 C2 . VE.
d'où : xE =nE (Cr2O72-) et nex (Fe2+) = 6xE = 6 nE (Cr2O72-). De plus nE (Cr2O72-) = C2 VE d'où : nex (Fe2+) = 6C2 VE. Calculer nex (Fe2+). nex (Fe2+) = 6C2 VE = 6*1,7 10-2 * 10 10-3 = 1,0 10-3 mol. Déduire la valeur de la quantité de matière nR(Fe2+) en ions fer(II). nR(Fe2+) = ni (Fe2+) - nex (Fe2+). ni (Fe2+) =V1 [Fe2+]i = 20,0 10-3* 0,20 =4,0 10-3 mol ; nR(Fe2+) = 4,0 10-3 -1,0 10-3 ~3,0 10-3 mol.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||