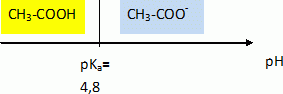|
L'acidité d'un vin : bac S Liban 2011. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
L’acidité d’un vin peut être exprimée de deux façons, à partir de son acidité totale ou de son pH [...]. L’acidité totale est surtout un indicateur des caractéristiques gustatives, alors que le pH intervient dans la stabilité du vin. L’acidité du vin (pH compris entre 2,7 et 3,7) est principalement due à la présence d’acides organiques en partie à l’état libre; l’acidité totale d’un vin est constituée par les acides représentant l’acidité fixe (acides tartrique, malique, lactique, citrique, etc) et par des molécules représentant l’acidité volatile (essentiellement l’acide éthanoïque, et l’éthanoate d’éthyle susceptible de libérer l’acide éthanoïque par saponification) [...]. Le goût aigre de l’acide éthanoïque est perçu lorsque sa concentration est supérieure à 0,6 g.L-1. D’après « Chimie dans la maison » - Cultures et Techniques. Données. Masse molaire de l’acide éthanoïque (CH3COOH) : M = 60 g.moL-1 ; à 25°C : pKa (acide éthanoïque/ion éthanoate) = 4,8 pKa (acide lactique/ion lactate) = 3,9 ; pKa (ion oxonium/eau) = 0 ; pKa (eau/ion hydroxyde) =14 ; produit ionique de l’eau : Ke = 1,0×1014. À propos du texte. Déterminer la valeur de la concentration molaire en ions oxonium H3O+ d’un vin dont le pH est égal à 3,0. [H3O+] = 10-pH = 1,0 10-3 mol/L. Calculer la concentration molaire de l’acide éthanoïque pour que le goût aigre soit perçu. concentration molaire (g/mol) = titre massique ( g/L) / masse molaire ( g/mol) c = 0,6 / 60 = 0,01 mol/L.
Réaction de l’acide éthanoïque avec l’eau.
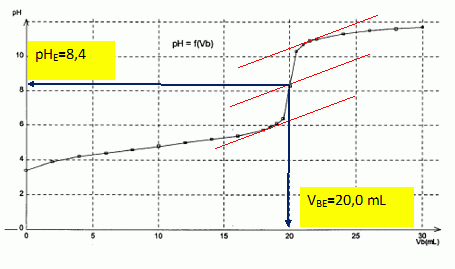
Titrage de l’acide éthanoïque par une solution d’hydroxyde de sodium. Au laboratoire, l’étiquette d’un flacon d’une solution d’acide éthanoïque est effacée. On décide alors d’effectuer un titrage afin de déterminer la concentration molaire de cette solution. Pour cela, on dispose d’une solution d’hydroxyde de sodium (Na+ + HO-) de concentration molaire égale à 1,0 10-2 mol.L-1 et du matériel suivant : - fioles jaugées de 50 mL et de 100 mL ; - pipettes jaugées de 5 mL et de 10 mL ; - bécher de 100 mL ; - éprouvette graduée de 50 mL ; - eau déminéralisée. Avec la solution d’hydroxyde de sodium ainsi préparée, on procède au titrage de Va = 20,0 mL de solution d’acide éthanoïque. Les valeurs du pH, en fonction du volume Vb de solution d’hydroxyde de sodium versé, sont données dans le tableau suivant :
CH3COOH aq + HO-aq = CH3COO-aq + H2O(l). Exprimer la constante d’équilibre associée à cette équation, puis la calculer. K = [CH3COO-aq] / ([CH3COOH aq][HO-aq]). Or Ka = [CH3COO-aq] [H3O+aq]/ [CH3COOH aq] soit [CH3COO-aq] / ([CH3COOH aq] = Ka / [H3O+aq]. Repport dans l'expression de K : K = Ka / ([H3O+aq][HO-aq]) = Ka /Ke =10-4,8 / 10-14 = 10 9,2 =1,6 109.
Pour un volume versé de 10,0 mL de solution d’hydroxyde de sodium, le pH a une valeur de 4,8. Calculer la quantité nV(HO-) d’ions hydroxyde versés depuis le début du titrage. nV(HO-) = cb Vversé =1,0 10-2 *1,00 10-2 = 1,0 10-4 mol. A partir de la valeur du pH, calculer la quantité nR(HO-) d’ions hydroxyde restants dans la solution. [HO-] =Ke / 10-pH = 10-14 / 10-4,8 =6,3 10-10 mol/L. nR(HO-) = [HO-] fois volume de la solution =6,3 10-10 *30 10-3 =1,9 10-11 mol. Comparer nV(HO-) et nR(HO-). Comment peut-on alors qualifier la transformation qui correspond à ce titrage acido-basique ? nV(HO-) >>nR(HO-). La transformation est totale. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|