|
Synthèse du salicylate de méthyle : bac S Antilles 09/ 2011. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
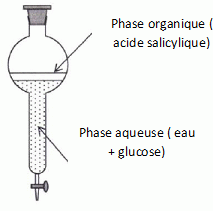
Extraction de l'acide salicylique. Cette extraction se fait par hydrodistillation. On réduit en poudre 435 g d'écorce de saule que l'on place dans un ballon. On ajoute 1 L d'eau distillée et on introduit le ballon dans un montage d'hydrodistillation. Après 30 minute, on recueille le distillat dans lequel l'espèce présente est la salicine. En faisant bouillir le distillat faiblement acidifié, on provoque son hydrolyse ; la salicine se décompose en glucose et en acide salicylique. A l'issue de cette opération, on réalise l'extraction de l'acide salicylique par le cyclohexane. Après isolement de la phase organique de l'ampoule à décanter et évaporation du cyclohexane dans un dispositif adapté, on recueille une masse m1 =8,7 g d'acide salicylique Identifier le montage d'hydrodistillation en justifiant. 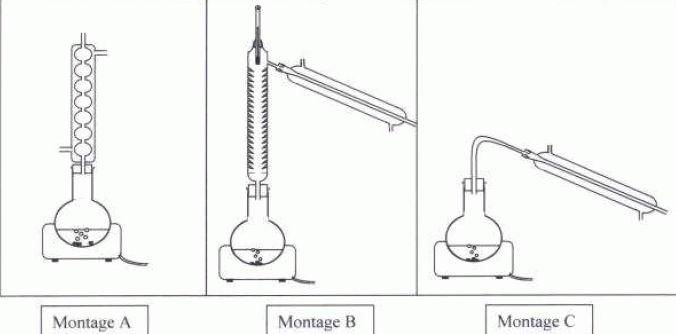 Montage A : chauffage à reflux ; montage B : distillation fractionnée; montage C : hydrodistillation. Lors de l'ébullition du mélange, la vapeur d'eau entraîne avec elle la vapeur de salicine.
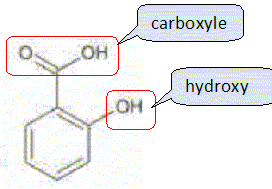
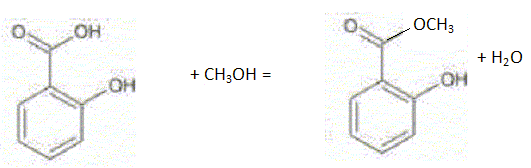 L'acide salicylique est solide à 20°C ( Tfusion = 159 °C) ; le méthanol et l'eau sont des liquides à 20°C ( Tfusion méthanol = -98 °C ; Tébullition méthanol = 65 °C ) Le salicylate de méthyle est liquide à 20°C ( Tfusion = -8,6 °C ; Tébullition =223 °C ). Donner deux propriétés des transformations associées à ce type de réaction chimique. Estérification lente et limitée par la réaction inverse, l'hydrolyse de l'ester.
On introduit m1 = 8,7 g d'acide salicylique dans un ballon, dans lequel on verse un volume V = 10,0 mL de méthanol, quelques gouttes d'acide sulfurique et quelques grains de pierre ponce. Après plusieurs heures de chauffage à reflux, on refroidit le mélange réactionnel à température ambiante. On ajoute environ 100 mL d'eau dans le mélange et on verse dans l'ampoule à décanter. On extrait la phase organique avec du cyclohexane : cette phase a une masse volumique proche de celle du cyclohexane et contient l'ester et quelques traces d'acide. On lave ensuite plusieurs fois cette phase aqueuse avec une solution aqueuse de'hydrogénocarbonate de sodium afin d'éliminer les acides restant dans la solution. Il se produit un dégagement gazeux. On effectue à nouveau un lavage àl'eau. On sépare les constituants de la phase organique par distillation. Après purification on récupère une masse m3 = 6,1 g de salicylate de méthyle. Expliquer le principe et les avantages du chauffage à reflux. On acélère une réaction lente en travaillant à température modérée ; on ne perd pas de quantité de matière : les vapeurs qui s'échappent du ballon, se condensent dans le réfrigérant droit et retombent dans le milieu réactionneln. Expliquer le rôle de l'acide sulfurique et de la pierre ponce. L'acide sulfurique joue le rôle de catalyseur ; la pierre ponce régularise l'ébullition. Ecrire l'équation de la réaction entre les ions hydrogénocarbonate HCO3- aq et les acides restants notés simplement AH. HCO3- aq + AHaq = A- aq+ H2O(l) + CO2(g). HCO3- aq joue le rôle de base. Il s'agit d'une réaction acide - base. Le dioxyde de carbone dissout est l'acide conjugué de HCO3- aq.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|