Exercice 1 (5 points) :
Datation au carbone 14Le carbone possède deux isotopes stables : le carbone 12 (très majoritaire dans la
nature) et le carbone 13 (minoritaire). Le carbone 14 est un isotope radioactif du
carbone. Les scientifiques s’en servent pour estimer l’âge d’objets anciens : œuvres
d’art, fossiles…
Cet exercice a pour objectif d’étudier la désintégration radioactive du carbone 14.
1.
Donner la composition des noyaux de carbone
126C et
146C
126C : 6 protons et 6 neutrons ; 146C 6 protons et14-6 = 8 neutrons.
2.
Indiquer pourquoi ces noyaux sont qualifiés d’isotopes.
Ils ont le même nombre de protons et des nombres de neutrons différents.
Le carbone 14 subit une désintégration de type ß-
.
3. Recopier sur sa copie et compléter l’équation de la réaction nucléaire suivante :
146C -->
147N+
0-1e .
La loi de désintégration radioactive suit l’équation : dN(t) = –
l N(t) /dt ; où N(t) est le
nombre de noyaux radioactifs à l’instant t, et
l est la constante de la désintégration, avec
l > 0. Ainsi le nombre de noyaux radioactifs vérifie l’équation différentielle du 1
er ordre :
(E) : y ’ = –
l y
où y est une fonction de la variable réelle t, exprimée en année, définie et dérivable sur
[0 ; +∞[. La fonction y représente le nombre de noyaux radioactifs.
4. En considérant y(0) = 100, montrer que pour t ≥ 0 : y(t) = 100 exp(
–
λt
).
Solution générale de l'équation y(t) = A exp(-
lt) avec A une constante réelle.
y(0) = 100 = A.
y(t) = 100
exp(-l t).
5. Déterminer la limite de y(t) lorsque t tend vers +∞.
Le terme en exponentielle tend vers zéro et y(t) tend vers zéro.
6. Résoudre l’équation y(t) = 50. Donner la réponse en fonction de
l.
50 =100 exp(-
lt) ; 0,5 =
exp(-lt) ; ln(0,5) = -ln(2)= -l t ; t = ln(2) / l.
7. Déterminer
graphiquement la valeur du temps de demi-vie t
½. La construction graphique doit
apparaître .
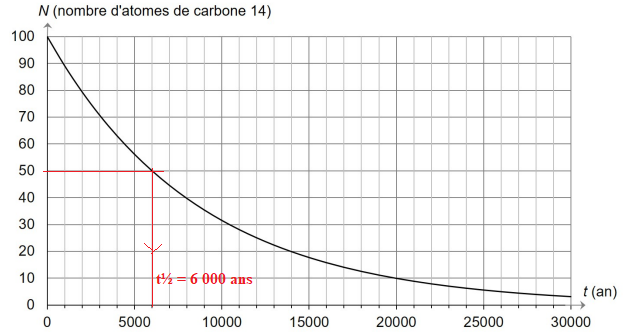
.
On sait que :
t
½ =
ln(2)
/
l
.
8. En déduire la valeur de la constante de désintégration
l. En donner une valeur
arrondie à 10
– 5
.
l = ln(2) / 6000~1,2 10
-4 an
-1.
Exercice 2. 6 points.
Comprimé effervescent d'aspirine.
On étudie ici l’intérêt d’utiliser un comprimé effervescent d’aspirine plutôt qu’un comprimé
ordinaire.
Données
Formule brute de l’acide acétylsalicylique : C
9H
8O
4
.
Masse molaire moléculaire de l’acide acétylsalicylique : M = 180 g·mol
–1
.
L’ion acétylsalicylate de formule brute C
9H
7O
4
–
est la base conjuguée de l’acide
acétylsalicylique.
Couple acide-base
C9H8O4
(aq)/
C9H7O4
–
(aq) : pKa = 3,5 à 25 °C.
L’acide acétylsalicylique est peu soluble dans l’eau (3 g L
–1 à 20 °C).
Le salicylate de sodium NaC
9H
7O
4 est très soluble dans l’eau.
L’acide acétylsalicylique est lipophile, il pénètre la paroi de l’estomac et cause des
irritations.
La formule semi-développée de l’acide acétylsalicylique est donnée ci-après.
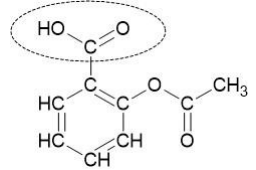
1. Nommer la fonction chimique associée au groupe caractéristique entouré sur la
représentation précédente.
Fonction acide carboxylique.
Ce groupe caractéristique de la molécule est à l’origine des propriétés acides de l’acide
acétylsalicylique. Sa base conjuguée est l’ion acétylsalicylate C
9H
7O
4
–
.
2. Représenter sur votre copie la formule semi-développée de l’ion acétylsalicylate.
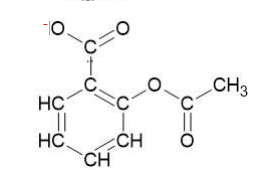 3.
3. En comparant la formule semi-développée de l’acide acétylsalicylique et celle de l’ion
acétylsalicylate, proposer une interprétation de la différence de solubilité dans l’eau
entre les deux espèces chimiques correspondantes.
L’ion
acétylsalicylate est plus polaire que l’acide acétylsalicylique ; l'eau est un solvant polaire. L’ion
acétylsalicylate est plus soluble dans l'eau que l'acide acétylsalicylique.
Dissolution d’un comprimé ordinaire d’aspirine.
Un comprimé ordinaire d’aspirine contient 500 mg d’acide acétylsalicylique. Il est broyé
et placé sous agitation dans un volume V = 200 mL d’eau distillée. La dissolution de
l’aspirine est lente et complète. On mesure le pH de la solution obtenue : pH = 2,7.
4. Déterminer la valeur de la concentration en quantité de matière apportée en acide
acétylsalicylique dans la solution obtenue, notée C
0 (en mol·L
–1).
n =masse (g) / masse molaire ( g / mol) = 0,500 / 180 =2,78 10
-3 mol.
C
0 = n / V = 2,78 10
-3 / 0,200 =1,39 10
-2 mol / L.
L’acide acétylsalicylique est un acide faible dans l’eau. L’équation de la réaction
chimique associée est :
C
9H
8O
4
(aq) + H
2O(l) = C
9H
7O
4
–
(aq) + H
3O
+
(aq).
5. Donner la définition d’un acide (selon Brönsted) ainsi que celle d’un acide faible.
Un acide est une espèce, ion ou molécule, susceptible de libérer un proton H
+.
Un acide faible réagit partiellement avec l'eau.
L’expression du coefficient de dissociation
a de l’acide acétylsalicylique dans l’eau s’écrit :
a =
[H
3O
+
]
/C
0 .
Montrer que le coefficient de dissociation
a pour valeur 0,14. Expliquer pourquoi
cette valeur confirme que l’acide acétylsalicylique est un acide faible.
a=10
-2,7 / (1,39 10
-2)=0,14.
a est très inférieur à 1 : cet acide est qualifié de faible.
Dissolution d’un comprimé effervescent d’aspirine
On utilise maintenant un comprimé effervescent d’aspirine. Le comprimé effervescent
contient 500 mg d’acide acétylsalicylique, ainsi que de l’hydrogénocarbonate de sodium
NaHCO
3
(s). On place le comprimé dans un volume V = 200 mL d’eau distillée. On
observe un dégagement gazeux important. La dissolution du comprimé est rapide et
complète. Le pH de la solution obtenue a pour valeur : pH = 5,8.
Données :
- Le diagramme de prédominance dans l’eau (à 25°C) pour les couples associés à
l’ion hydrogénocarbonate, est donné ci-après sans souci d’échelle :
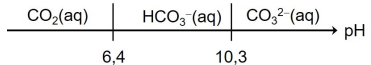
Le dioxyde de carbone gazeux CO
2(g) est peu soluble dans l’eau.
7. En utilisant le diagramme de prédominance précédent, proposer une interprétation
au dégagement gazeux observé.
A pH=5,8, la forme CO
2 prédomine. Ce dernier est peu soluble dans l'eau. Il se dégage.
8. Représenter le diagramme de prédominance pour le couple associé à l’acide
acétylsalicylique. En déduire l’espèce prédominante dans la solution obtenue.
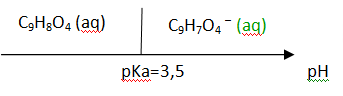
A pH = 5,8 la forme
C9H7O4
–
.
prédomine.
9. Proposer une explication à la meilleure solubilité de l’aspirine dans l’eau avec un
comprimé effervescent.
La forme C9H7O4
–
.
polaire prédomine. L'eau est un solvant polaire.
10. Déduire des questions précédentes et des données, pourquoi l’utilisation d’un
comprimé effervescent d’aspirine irrite moins la paroi de l’estomac que l’utilisation
d’un comprimé ordinaire d’aspirine.
Le pH de la solution d'aspirine effervescente est peu acide ( pas de brûlure d'estomac).