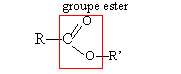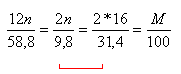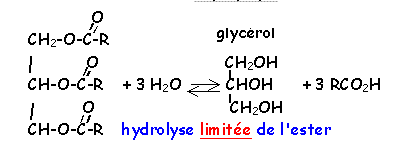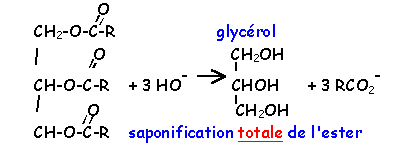|
exercice
1
|
extraction
du benzoate de méthyle
|
On cherche à extraire un ester, le
benzoate de méthyle d'un mélange
contenant en plus, de l'acide benzoique, de l'eau,
de l'acide sulfurique. Dans une ampoule à
décanter, on ajoute à ce
mélange, de l'éther, puis un
excès de solution de soude.
|
espèces
|
densité
|
solubilité dans
l'eau
|
solubilité dans
l'éther
|
|
benzoate de
méthyle
|
|
très faible
|
très grande
|
|
acide benzoique
|
|
très faible
|
|
|
ion benzoate
|
|
très grande
|
très faible
|
|
ether
|
0,74
|
très faible
|
|
|
eau
|
1
|
|
très faible
|
|
autres ions
|
|
très grande
|
très faible
|
- Quelle est la nature de la phase
inférieure?
- Que contient-elle ?
- Que ce serait-il passer en absence de
soude?
|
|
|
corrigé
|
|
|
L'ether et l'eau sont
deux liquides qui ne se mélangent pas. Ils
sont non miscibles et constituent 2 phases
superposées. Le liquide le plus dense
(l'eau) est en dessous de l'éther.
L'eau
contient tous les
ions; l'ether peut
contenir le benzoate de méthyle et l'acide
benzoique.
L'acide benzoique et l'ion
benzoate constitue un couple acide base. En milieu
basique , la forme ion benzoate prédomine.
La forme ac benzoique est en quantité
très faible.
|
|
|
|
exercice
2
|
obtention
du rilsan
|
|
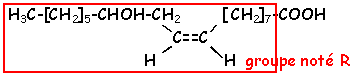
L'acide
récinoléique a pour formule
H3C (CH2)5-CHOH
CH2 CH=CH
(CH2)7-COOH
masse molaire=298
gmol-1.
Na=23 ; O=16 ; H=1
C'est la
matière première de fabrication du
rilsan.
- Ecrire la formule semi
développée sachant que la
configuration est Z.
- Cet acide est obtenu
par hydrolyse de l'huile de ricin. Donner la
formule semi développée de cet
huile sachant que cette hydrolyse donne aussi du
glycérol.
- Quelle est la masse de
soude nécessaire pour saponifier 100 kg
d'huile de ricin ?
Un kilogramme d'acide
ricinoléique donne 0,68 Kg de
monomère de rilsan. Quelle mase de ce
monomère obtient-on à partir de 100
kg d'huile de ricin ?
|
|
|
corrigé
|
|
|
|
|
masse molaire de l'huile de
ricin: 297*3+3*12+5= 932 g
Qté de
matière d'huile: 100 *1000/932 =
107,3
mol
Qté de
matière de soude NaOH: 3*107,3 =321,9
mol
masse de soude =
qté matière * masse molaire soude
=321,9*40=
12,87 kg
Une mole d'huile
donne 3 moles d'acide par hydrolyse donc 107,3 mol
d'huile donne 321,9 moles d'acide soit en masse
:321,9*298=
95,92 kg
d'acide.
masse de rilsan
95,92*0,68=65,3
kg.
|
|
|
|
exercice
3
|
synthèse
d'un médicament
|
|
Un anhydride d'acide
noté A a une masse molaire de 102 g
mol-1.
C=12; H=1; O=16 ;
N=14g mol-1.
- Identifier A; nom, formule semi
développée.
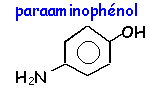
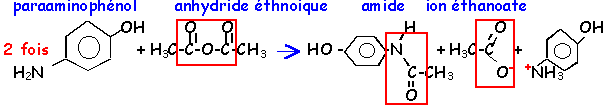
- L'action de A sur le paraamminophénol
donne un amide et d'autres produits. Ecrire
l'équation bilan.
Quelle masse d'amide peut-on obtenir
à partir de 5,45 g de paraaminophénol
et 8 mL d'anhydride A ( liquide de densité
1,08 par rapport à l'eau)
|
109 g mol-1
|
|
|
|
corrigé
|
|
|
|
|
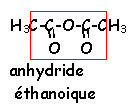
anhydride d'acide
formule brute
CnH2n-2O3
|
|
anhydride
éthanoique
|
paraaminophénol
|
|
masse molaire
g
mol-1.
|
102
|
109
|
|
masse
gramme
|
8*1,08=8,64
|
5,45
|
|
qté matière
mol
|
8,64/102=
0,0847
|
5,45/109=
0,05
|
|
coéfficient
équation
|
1
|
2
|
|
excés
|
réactif
en défaut
|
il se forme 0,025 mol d'amide soit en masse :
masse molaire amide:151 g mol-1 .
151*0,025= 3,78
g
|
|
|
exercice
4
|
l'acétanilide
|
|
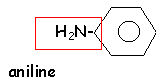
L'acétanilide est
obtenu par réaction entre l'aniline et
l'anhydride éthanoique.
C=12; H=1; N=14
gmol-1.
- Ecrire la formule semi
dévelopée de
l'acétanilide.
- Ecrire
l'équation bilan.
- A partir de 0,11 mol
d'aniline et 0,17 mol d'anhydride
éthanoique, quelle masse
d'acétanilide peut-on obtenir
?
|
|
|
|
|
corrigé
|
|
|
|
|

|
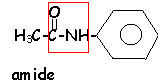
F noyau
benzénique
C6H5-
|
|
0,11 mol d'aniline réagit
avec 0,11 /2 =0,055 mol d'anhydride
éthanoique:
aniline en
défaut
donnant 0,055 mol d'amide
|
masse amide (g) =
masse molaire de
l'amide(gmol-1)*0,055
mol=
7,4
g
|
|
|
|
exercice
5
|
chlorure
d'acide + eau
|
|
On hydrolyse un chlorure d'acyle de formule
R-COCl. IL se forme du chlorure
d'hydrogène.
- Ecrire l'équation bilan de la
réaction.
- On dispose de 1,5 g de chlorure d'acyle pur.
Le HCl formé est intégralement
recueilli dans un certain volume d'eau pure. On
obtient ainsi la solution S dans laquelle on
ajoute quelques gouttes de bleu de bromothymol.
Il faut verser dans la solution S : 19,1
cm3 d'une solution de soude à
1 mole par litre pour obtenir le virage de
l'indicateur coloré. En déduire la
masse molaire du chlorure d'acyle ainsi que sa
formule, sachant que la chaîne
carbonée est saturée. On rappelle
que le virage de l'indicateur coloré se
produit au point d'équivalence.
corrigé
R-COCl + H2O donne R-COOH + HCl
19,1 mmol de soude donc 19,1 mmol HCl à
l'équivalence du dosage acide fort base
forte
donc 19,1 mmol R-COCl
0,0191 = 1,5 / masse molaire
masse molaire = 78,5 g/mol
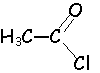
Cn H2n-1ClO :
12n+2n-1+16+35,5 =78,5
n =2 d'où C2H3ClO
chlorure
d'éthanoyle.
|
retour
- menu
|