|
diagramme de cristallisation HNO3_H2O; diagramme solide-liquide ; En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
||||||||
|
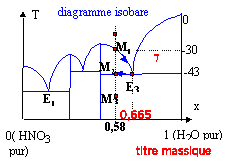
On rappelle que la courbe supérieure donne la température d'apparition dans une solution aqueuse d'acide nitrique, d'un cristal solide dont la nature est indiquée par la verticale limitant le domaine atteint. E1, E2 et E3 représentesnt des eutectiques du système. 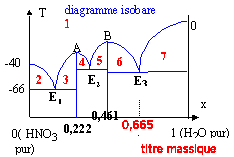
corrigé masse molaire du composé défini HNO3, xH2O : 63+18x. fraction massique en eau : 18x / (63+18x) pour le composé défini A : 18x / (63+18x) = 0,222 soit x = 1 et HNO3, H2O. pour le composé défini B : 18x / (63+18x) = 0,461 soit x = 3 et HNO3, 3H2O. titre massique en eau de la solution 8,44 molaire en acide nitrique : masse de 1L de cette solution : 1226 g masse d'acide pur : 8,44*63 = 531,7 g soit 1226-531,7 = 734,3 g d'eau titre massique en eau : 734,3/1226 = 0,58 ( ou 58%).
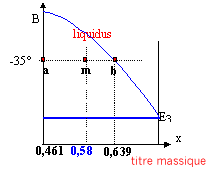
En refroidissant le liquide, les premiers cristaux du composé défini HNO3, 3H2O apparaissent vers -30°C (point M1) et le titre massique du liquide varie de 58 % à 66,5% (titre massique de l'eutectique E3). La température reste alors égale à -43°C tout le temps que l'eutectique cristallise (point M2) puis lorsque tout le liquide a disparu il reste deux phases solides HNO3, 3H2O et H2O(s) (point M3). application du théorème des moments chimiques : Le théorème des moments chimiques implique l'utilisation des fractions molaires. L'isotherme -35°C coupe la courbe BE3 du liquidus à un titre massique t = 0,639. La fraction molaire de l'eau se calcule de la manière suivante : x =[t /18 ] / [t /18 + (1-t )/ 63] soit à t 1 = 0,461 correspond x1 = 0,75 ; soit à t 0 = 0,58 correspond x0 = 0,83 ; soit à t 2 = 0,639 correspond x2 = 0,86 ; théorème des moments : NS/Nl = (x2 -x0) / (x0 -x1) = 3/8 = 0,375. NS et Nl désigne respectivement les nombres de moles du solide HNO3, 3H2O et du liquide. calcul des masses du liquide et du solide : conservation de l'azote : NS+Nl = 8,44 NS/Nl =0,375 doù Nl=6,14 mol et NS= 2,3 mol masse du solide : 2,3* (63+3*18) = 269 g masse du liquide 1266-269 = 997g. à -80°C coexistent les cristaux de HNO3, 3H2O et des cristaux de glace. HNO3, 3H2O : 8,44 *(63+3*18) = 987,5 g glace 1266-987,5 = 278,5 g
Nature des phases en équilibre stable dans les domaines 1 à 7 : 1 : liquide HNO3 et H2O ; 2 : cristaux HNO3 + liquide ; 3 et 4 : cristaux HNO3 , H2O + liquide 5 et 6 : cristaux HNO3 , 3H2O + liquide; 7 : cristaux de glace + liquide |
||||||||
|
|
||||||||
|
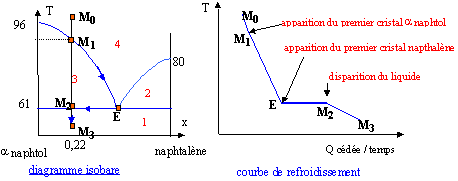
corrigé Le diagramme d'équilibre est celui d'un diagramme de deux corps non miscible à l'état solide, mais entierement miscible à l'état liquide.
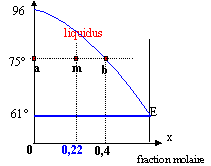
En désignant par A l'a naphtol et B le naphtalène : 1 : cristaux de A et cristaux de B ; 2 : cristaux de A + liquide (A et B) ; 3 : cristaux de A + liquide (A et B) ; 4 : liquide ( A et B) A partir du point M0 on refroidit lentement le mélange liquide : x0 = (10/128 ) / (10/128 + 40/144) = 0,22. Lorsque l'on rencontre le liquidus (point M1) apparaissent les premiers cristaux d'a naphtol (T voisin 88°C) La composition du liquide décrit la courbe M1E. A 61°C la composition de l'eutectique est atteinte dans le liquide. La température reste alors constante jusqu'au point M2, puis les deux solides A et B sont refroidits (point M3). La détermination des masses des corps en présence est déterminée en utilisant le théorème des moments chimiques :
à 75°C : conservation du nombre de moles : NS+Nl = 10/128 + 40/144 = 0,356 mol NS/Nl =(0,4-0,22) / (0,22-0) = 0,818 doù Nl=0,196 mol et NS= 0,16 mol masse du solide :0,16* 144 = 23 g masse du liquide 50-23 = 27 g dont 40-23 = 17 g d'a naphtol et 10 g naphtalène. à 50°C coexistent les cristaux de de A (40g) et B (10 g).
retour - menu |